已知: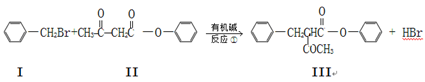
Ⅴ由化合物Ⅲ合成:
请回答下列问题:
(1)化合物Ⅱ的分子式为 ,Ⅲ的含氧官能团的名称为 。
(2)反应①~③中,属于加成反应的是 ____________。
(3)化合物II与足量的H2(Ni作催化剂)加成后再在酸性条件下水解,所得产物之一可以发生聚合反应,写出该聚合产物的结构简式为:______________________________。
(4)1 mol化合物Ⅱ与C9H8的混合物完全燃烧时消耗O2的量为__________mol。
(5)化合物II与NaOH溶液能很快完全反应,写出该反应方程式: 。
(6)化合物II也能发生类似反应②的反应得到一种分子中含3个碳原子的有机物,该物质的结构简式为 。
(7)写出满足下列条件的IV的同分异构体的结构简式 。
①苯环上只有两个处于对位的取代基; ②能发生银镜反应;③核磁共振氢谱有5组吸收峰
某无色透明溶液可能存在Na+、Fe3+、Ba2+、NO3-、CO32-、HCO3-、SO42-中的几种离子,现有如下操作:
Ⅰ、取适量该溶液加入CaCl2溶液无沉淀,继续滴加盐酸产生无色无味的气体。
Ⅱ、另取该溶液滴加一定量的NaOH溶液有白色沉淀生成。
试回答下列问题:
该溶液中一定存在的离子有______________,一定不存在的离子_____________。
用一个离子方程式表示操作②的实验现象:
________________________________________________________。
将总物质的量为4mol的Na2O2和Al2(SO4)3的混合物投入足量水中,充分反应后生成y mol沉淀(y>0)。若以x表示原混合物中Na2O2的物质的量,试建立y=f(x)的函数关系式,将x的取值和y=f(x)关系式填写在表内(可不填满,也可补充)。
| 序号 |
x值 |
y=f(x) |
| ① |
||
| ② |
||
| ③ |
||
| ④ |
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体, C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。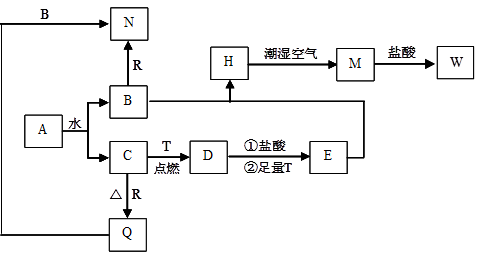
(1)写出下列物质的化学式:
A:D:R:。
(2)按要求写下列反应方程式:
H在潮湿空气中变成M的过程中的化学方程式:;
向N中通足量CO2时反应的离子方程式:;
D与盐酸反应的离子方程式:。
(3)简述检验气体C的方法:。
(1)相同物质的量浓度、相同体积的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,生成沉淀的质量之比为________。
(2)向等体积、等浓度的AgNO3溶液中,分别加入相同体积的NaCl、MgCl2、AlCl3溶液,恰好使它们中的Cl-完全转化为AgCl沉淀,则三种溶液的物质的量浓度之比为________。
(3)Na、Mg、Al分别与足量的硫酸溶液反应,当生成气体的质量相同时,消耗Na、Mg、Al的物质的量之比为________。
(4)足量的Al分别与等浓度的硫酸、氢氧化钠溶液反应,当生成气体的质量相同时,硫酸溶液和氢氧化钠溶液的体积比为________。
20 g烧碱配制成500 mL溶液,其物质的量浓度为________mol·L-1;从中取出1 mL,其中含溶质为______g。若将这1 mL溶液用水稀释到100 mL,所得溶液中含Na+______g。