某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。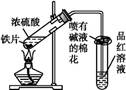
图1 图2
(1)比较两实验装置,图2装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
② 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而污染环境;二是 。
(3)能说明有SO2气体产生的实验现象是 。
(4)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀H2SO4溶液 | C.KSCN溶液 | D.KMnO4溶液 |
E.NaOH溶液 F.淀粉KI溶液 G.H2O2溶液
验证Ⅱ:取试样,先滴加少量的 (填试剂序号,下同),振荡,再滴加少量的 ,根据溶液颜色的变化可确定假设Ⅱ是否正确。反应的离子方程式是 ,Fe3++3SCN- Fe(SCN)3。
Fe(SCN)3。
验证Ⅲ:步骤1.取试样,滴加少量的 (填试剂序号),溶液的颜色变 色,则试样中含有Fe3+。
步骤2.再取适量的试样滴加到少量的 (填试剂序号),观察到的现象为 ,则试样中含有Fe2+。
.二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是 。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下: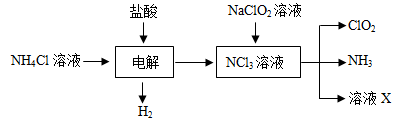
(2)写出电解时发生反应的化学方程式:;
(3)除去ClO2中的NH3可选用的试剂是;(填序号)
| A.饱和食盐水 | B.碱石灰 | C.浓硫酸 | D.水 |
(4)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液。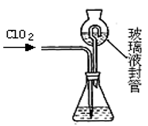
①装置中玻璃液封管的作用是;
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ;
③滴定终点的现象是:。
④测得通入ClO2的质量m(ClO2)=。(用含c、V的代数式表示)
(5)用ClO2处理过的饮用水(PH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2—。2001年我国卫生部规定,饮用水的ClO2—含量应不超过0.2mg/L。若饮用水中
ClO2—的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是(填化学式)。
某同学要对某溶液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
(1)
| 实验目的 |
操作 |
实验现象 |
结论 |
| 1.检验Cl— |
取少许滤液于试管中, |
含有Cl— |
|
| 2.检验NH4+ |
取少许滤液于试管中, |
含有NH4+ |
|
| 3.检验Zn2+ |
取少许滤液于试管中,加入稀氨水 |
先产生白色沉淀,继续加入氨水,沉淀又溶解 |
含有Zn2+ |
(2)根据以上的实验报告,关于滤液的成分,他的结论是:滤液中含有氯化铵和氯化锌
若想从滤液中得到溶质固体,还应进行的操作是加热蒸发(加热浓缩),, 过滤。
若要将所得的溶质固体中的物质加以分离,可用法。
某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验: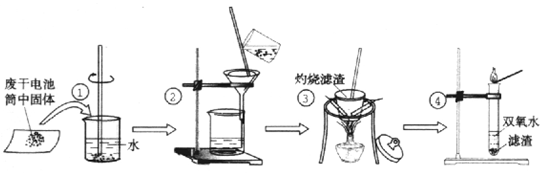
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1) 操作①的名称是;操作②的名称是;
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、、和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为。
(3) 操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为。
中学化学中几种常见物质的转化关系如图所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体。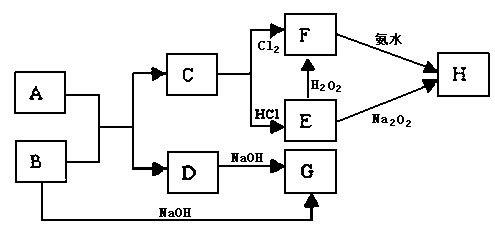
请回答下列问题:
(1)红褐色胶体中H粒子的直径大小范围;
(2)写出D的一种工业用途:;
(3)①写出H2O2的电子式:;
②写出B→G的离子方程式;
(4)若A、B恰好完全反应,将产物C与足量盐酸反应得到a mol气体,另取等质量B与足量盐酸反应得到b mol气体,a:b=5:7,则A的化学式为;
(5)用石墨作电极,电解G加入过量盐酸后的溶液(如右图),两极产生气 泡。持续电解一段时间,在X极附近的溶液中还可观察到的现象 是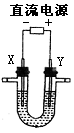 ,解释此现象的离子方程式是。
,解释此现象的离子方程式是。
断开电源,将电解后的溶液倒入烧杯中充分搅拌,现象是,原因是。
某化学兴趣小组利用实验室提供的下列试剂:铁粉、0.1mol·L-1FeCl3溶液、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并对实验结果加于应用。
(1)兴趣小组通过对Fe2+、Fe3+ 的价态分析,对Fe2+、Fe3+ 的氧化性、还原性提出了如下3种假设:
假设一:Fe2+具有性;
假设二:Fe2+具有性;
假设三:Fe3+具有性;
(2)设计实验方案,进行实验并描述实验现象,完成下列表格。
| 探究内容 |
实验方案 |
实验现象 |
写出下列离子方程式 |
| 探究Fe2+具有还原性 |
取少量0.1mol·L-1FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量 |
溶液先不变红, 后变为血红色 |
①Fe2+发生的反应: |
| 探究Fe3+具有氧化性 |
取少量0.1mol·L-1FeCl3溶液,加入足量后,再往溶液中加入少量KSCN溶液 |
溶液不变为血红色 |
②Fe3+发生的反应: |
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了一个反应事实:FeCl2 + Zn ="=" ZnCl2 + Fe
该反应的离子方程式为:。
(4)根据Fe3+的性质,该兴趣小组利用FeCl3溶液腐蚀铜箔制造印刷线路板,反应的离子方程式是:。