甜樱桃中含有一种羟基酸(用A表示),A的碳链结构无支链,分子式为C4H6O5,1.34 g A与足量NaHCO3溶液反应,生成标准状况下的气体0.448 L。A在一定条件下可发生如下转化:
A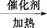 B
B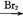 C
C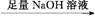 D
D E
E
其中,E的分子式为C4H6O6。已知: +
+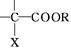

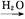
 +Zn(OH)X
+Zn(OH)X
(X代表卤原子,R代表烃基),A的合成方法如下:
①F+BrCH2—COOCH2CH3
 G+Zn(OH)Br
G+Zn(OH)Br
②G+2H2O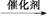 A+2M(其中,F、G、M分别代表一种有机物)
A+2M(其中,F、G、M分别代表一种有机物)
请回答下列问题:
(1)E的结构简式为 ,E的核磁共振氢谱中会出现 组峰,一分子E最多能与 分子乙醇发生分子间脱水反应。
(2)从A到D所发生的化学反应的类型依次是 。
(3)F的分子式是 。写出满足下列条件的F的同分异构体的结构简式:①能与NaHCO3反应,且常温下能使溴水褪色;②不能发生银镜反应;③1 mol该同分异构体与足量钠反应,标准状况下可得到22.4 L氢气(注:羟基不能直接与双键相连)。
(4)写出G与水反应生成A和M的化学方程式 。
(8分)U、W、X、Y、Z都是短周期元素,且原子序数依次增大。其中U与W可形成三角锥形分子甲,U与X可形成常温下呈液态的分子乙,甲、乙均为10 电子分子;Y 元素原子的 K 层电子数与M层电子数相同;Z元素的单质、氧化物均为原子晶体。请回答下列问题:
(1) Z元素在周期表中的位置。
(2)X、Y、Z三种元素的原子半径由小到大的顺序是(用元素符号表示)。
(3)U与X形成的18电子化合物的电子式是。
(4) ZX2与NaOH溶液反应的化学方程式是。
(5)已知:① N2(g) + 3H2 (g)= 2NH3 (g)△H=-92.4kJ/mol
②2H2(g) + O2(g) = 2H2O(g)△H=-483.6kJ/mol
试写出氨气完全燃烧生成气态水的热化学方程式。
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
Ⅰ、(1)在一定条件下,SO2转化为SO3的化学反应为2SO2(g)+O2(g)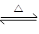 2SO3(g),该反应的平衡常数表达式为K=;过量的SO2与NaOH溶液反应的化学方程式为。
2SO3(g),该反应的平衡常数表达式为K=;过量的SO2与NaOH溶液反应的化学方程式为。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是、。
(3)通氯气氧化时,发生的主要反应的离子方程式为;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式)。
Ⅱ、 已知: CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如图所示: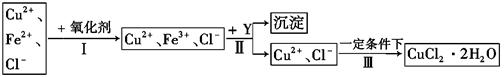
请回答下列问题:
(4)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的(填字母)。
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为。
(5)在步骤Ⅱ中,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的(填字母)。
A.NaOH B.Cu C.Cu2(OH)2CO3
(6)步骤Ⅲ应控制的实验条件是。
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是。
(2)写出C、H物质的化学式:C,H。
(3)写出反应①、⑦的化学方程式:
反应①:;
反应⑦:。
(4)反应⑥过程中的现象是。
按要求完成下列各题。
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为:。
(2)ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式:。
(3)MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,反应的化学方程式为:。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为。
(4)(CN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为
。
已知几种离子的还原能力强弱顺序为I->Fe2+>Br-,现有200 mL混合溶液中含FeI2、FeBr2各0.10 mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其他反应)
(1)若氯水中有0.15 mol Cl2被还原,则所得溶液中含有的阴离子主要是________,剩余Fe2+的物质的量为________。
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为________,若最终所得溶液为400 mL,其中主要阳离子及其物质的量浓度为________。
(3)通过对上述反应的分析,试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是________________________。
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸)。试写出此反应的离子方程式:_________________;上述所有反应共消耗Cl2________mol。