已知25 ℃时弱电解质的电离平衡常数:
Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。
(1)将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与0.10 mol·L-1的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图所示。
反应开始时,两种溶液产生CO2的速率明显不同的原因是________;反应结束后所得溶液中c(SCN-)________c(CH3COO-)(填“>”、“=”或<)。
(2)2.0×10-3 mol·L-1的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示。则25 ℃时,HF电离平衡常数为Ka(HF)=________(列式求值)。
(3)难溶物质CaF2溶度积常数为Ksp=1.5×10-10,将4.0×10-3 mol·L-1 HF溶液与4.0×10-4 mol·L-1的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?________(填“有”或“没有”),简述理由:____________________________________________。
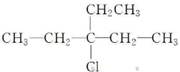
下列卤代烃在NaOH的醇溶液中加热得到的烯烃分别有几种?
(1)
(2)
已知卤代烃和NaOH的醇溶液共热可以得到烯烃,如: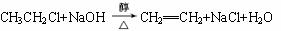
现通过以下步骤由 制取
制取 ,其合成流程如下:
,其合成流程如下: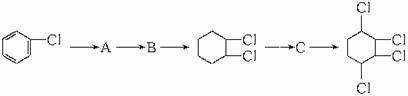
请回答下列问题:
(1)从左向右依次填写每步所属的反应类型是(a.取代反应 b.加成反应 c.消去反应)__________(只填写字母)。
(2)写出A B所需的试剂和反应条件。
B所需的试剂和反应条件。
石墨在加热和高压的条件下可加工成金刚石,这个变化是_____________(物理、化学)变化。
在碘化钾和硫酸的混合溶液中加入过氧化氢水溶液,迅速发生反应放出大量气体,反应过程可表示如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO;
③H2O2+2HIO=I2+O2↑+2H2O
(1)H2O2在反应③中的作用是______(填正确选项的标号)
| A.氧化剂 | B.还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂也不是还原剂 |
(2)有人认为上述反应说明了碘单质是过氧化氢分解的催化剂,你认为______________(填“对”或“不对”),其理由是___________________________________________.
(3)上述反应说明H2O2、I2、HIO氧化性从强到弱的顺序是_______>________>______.
固氮有三种方式:生物固氮、工业合成氨和放电条件下氮气与氧气化合。全世界工业合成氮肥中的氮只占固氮总量的20%,其余绝大多数是通过生物固氮进行的,最常见的是豆科植物根部的根瘤菌,能将大气中游离态的氮经固氮酶的作用生成氮的化合物,以利于植物利用。
(1)根瘤菌与豆科植物的关系在生物学上称为__________________;
(2)根瘤菌之所以有固氮作用,是因为它有独特的固氮酶,而最根本原因是它含有独特的___________________;
(3)日本科学家把固氮基因转移到水稻根际微生物中,通过指导合成固氮所需的_____________进而引起固氮作用。更为理想的是直接将固氮基因转移到稻、麦等粮食及经济作物的细胞中,让植物本身直接固氮,这样可以免施氮肥。如果这种愿望实现的话说,那么固氮基因中遗传信息表达途径为___________________________________;
(4)这种生物固氮与工业合成氨比较,它是在_____________条件下进行的,从而节省了大量的器材、设备和能源;
(5)俗话说“雷雨发庄稼”,因为电闪雷鸣的雨天,氮气在空气中发生一系列的反应,产生了植物可利用的含氮化合物,写出有关的三个反应方程式____________________、____________________________、
____________________________________。