用0.1320 mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
| 实验编号 |
待测NaOH溶液的体积/mL |
HCl溶液的体积/mL |
| 1 |
25.00 |
24.41 |
| 2 |
25.00 |
24.39 |
| 3 |
25.00 |
22.60 |
回答下列问题:
(1)图中甲为 滴定管,乙为 滴定管(填“酸式”或“碱式 ”);
(2)取待测液NaOH溶液25.00 mL 于锥形瓶中,使用 做指示剂,滴定终点的判断依据是 ;
(3)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果 (填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果 ;
(4)该NaOH溶液的物质的量浓度为 mol/L (保留小数点后四位有效数字)。
(14分)某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。
已知:常温下,CO能使一些化合物中的金属离子还原。例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl,反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。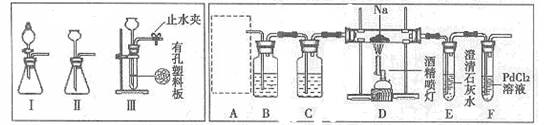
请回答下列问题:
(1)为了使制气装置能“随开随用,随关随停”,上图A处制取CO2气体应选用的装置是(填写“I”、“II”或“III”),其离子方程式是。装置B和C中应盛放的试剂分别是,。
(2)观察实验装置图可知Na与CO2反应的条件是,检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是,这步操作的目的是。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是。
(4)请判断②中D装置生成固体的成分是钠的(填“正盐”或“酸式盐”)。请用文字简要说明理由。
三草酸合铁酸钾晶体易溶于水,难溶于乙醇,可用作某些化学反应的催化剂,化学式为K3[Fe(C2O4)3]·3H2O。实验室以铁屑为原料制备三草酸合铁酸钾晶体相关反应过程如图所示:
请回答下列问题:
(1)制备过程中加入H2O2目的是______________,得到K3[Fe(C2O4)3]溶液后,需要加入乙醇,其目的是_________________。
(2)晶体中所含的结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复脱水、冷却、称量至恒重,⑥计算。步骤⑤的目的是___________________。
(3) 可被高锰酸钾溶液氧化放出CO2,测定产物中K3[Fe(C2O4)3]·3H2O含量时,可用酸性高锰酸钾标准溶液进行滴定。
可被高锰酸钾溶液氧化放出CO2,测定产物中K3[Fe(C2O4)3]·3H2O含量时,可用酸性高锰酸钾标准溶液进行滴定。
①写出滴定过程中发生反应的离子方程式_____________;
②取10.0g产物配成100mL溶液,从中取出20mL于锥形瓶中,用0.1mol·L-1的酸性高锰酸钾溶液进行滴定,达到滴定终点时消耗酸性高锰酸钾溶液24mL。则产物中K3[Fe(C2O4)3]·3H2O的质量分数为_________。(K3[Fe(C2O4)3]·3H2O相对分子质量为491)
亚硝酸钠在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略)。
已知:
①3NaNO2+3HCl 3NaCl+HNO3+2NO↑+H2O
3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO或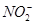 都能与
都能与 反应生成
反应生成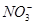 和Mn2+;
和Mn2+;
完成下列填空:
(1)写出a仪器的名称________________。
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为_________________。
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式______________;当该反应中转移0.1mol e-时,理论上吸收标准状况下NO的体积为___________L。
(4)D装置中发生反应的离子方程式为_____________________。
(5)将11.7g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭_____________g。
某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
已知:有关金属离子生成氢氧化物沉淀所需的pH如下图:
(1)滤渣1的主要成分为。
(2)电解脱铜:金属铜在极析出。
(3)①用离子方程式解释加入H2O2的作用。
②加Na2CO3调节溶液的pH至5,则滤渣2的主要成分为。
(4)从滤液2中获得NiSO4.6H2O的实验操作是、过滤、洗涤、干燥。
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理示意图如下:
①A极的电极反应式为和2H++2e-=H2↑。
②B极附近pH会(填“增大”、“减小”或“不变”);用平衡移动原理解释B极附近pH变化的原因:。
③若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),理论上能得到Nig。
3名同学在用氯酸钾和二氧化锰混合加热制取氧气的过程中,发现生成的气体有刺激性气味,针对这一“异常现象”进行了实验探究及分析。
(1)甲用湿润的KI-淀粉试纸检验上述生成的气体,观察到试纸变蓝,据此判断氧气中混有Cl2。用离子方程式解释甲判断试纸变蓝的原因。
(2)乙认为上述现象只能说明混合气体具有性,实验中使试纸变蓝的气体单质还可能是。为了进一步验证甲的推测,乙补充了一个实验:将上述生成的气体冷却后通入盛有溶液的洗气瓶中,若现象为,则甲的推测合理。
(3)丙查阅文献获知,这种方法制取氧气的过程中确有Cl2产生,并且查到了以下反应历程:
①2KClO3 + 2MnO2 → 2KMnO4 + Cl2 + O2↑
②反应②
③K2MnO4 + Cl2 → 2KCl + MnO2 + O2↑
总反应 2KClO3→2KCl + 3O2↑
丙设计实验,通过观察MnO4-的特征颜色来验证反应历程中①的发生,具体实验操作为:将一定量的KClO3和MnO2混合于试管中,加热,。写出历程中反应②的化学方程式。
(4)另据文献记载:此法制取的氧气中除了含有Cl2,还混有化合物ClO2。ClO2具有强氧化性,可以将污水中的S2-氧化成SO42-,反应的离子方程式为。