为了探究AgNO3的热稳定性,某化学兴趣小组设计了如下实验。用如图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。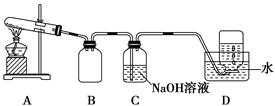
(1)装置B的作用是________。
(2)经小组讨论并验证该无色气体为O2,其验证方法是________________________________________。
(3)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
| 实验编号 |
操作 |
现象 |
| a |
加入足量氨水,振荡 |
黑色固体不溶解 |
| b |
加入足量稀硝酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是______(填实验编号)。
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有______。
(14分)某课外小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式。
(2)装置A中的烧瓶内固体宜选用(选填以下选项的代号)。
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格。
B、D、E。
(4)氯气和氨气在常温下相混合就会反应生成氯化铵和氮气,该反应的化学方程式为。
(5)若从装置C的G处逸出的尾气只含有N2和少量Cl2,应如何处理才能不污染环境?
。
某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L—1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。
| 方法 |
需测定的数据 |
| ① |
测定产生的H2的体积 |
| ② |
[实验二]向实验一的锥形瓶里滴加1 mol·L—1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。
[实验三]请设计合理实验检验实验二所得溶液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、滴管、1 mol·L-1NaOH溶液、1 mol·L-1HCl溶液、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。(可填满、可不填满)
| 实验操作 |
预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
|
| …… |
[实验四]粉末状试样A是由MgO和Fe2O3组成的混合物。取适量A进行铝热反应,产物中有单质B生成。产物中的单质B是(填化学式)。
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅱ所示。
(1)图Ⅰ、Ⅱ所示实验均能鉴别这两种物质,与实验Ⅰ相比,实验Ⅱ的优点是(填选项序号)。
| A.Ⅱ比Ⅰ复杂 | B.Ⅱ比Ⅰ安全 |
| C.Ⅱ比Ⅰ难操作 | D.Ⅱ可以做到用同一套装置进行对比实验,而Ⅰ不行 |
(2)若用实验Ⅱ验证碳酸钠和碳酸氢钠的稳定性。则试管B中应装入的固体最好是(填化学式)。
(3)某同学将质量为m1的NaHCO3固体放在试管中加热分解一段时间后,恢复到原条件,测得剩余固体的质量为m2。试管中发生的反应的化学方程式是
生成的Na2CO3的质量为。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。当碳酸氢钠与氢氧化钙物质的量之比为2∶1时,请设计实验检验反应后所得溶液中溶质的阴离子:
。
请设计实验:用MnO2与浓盐酸制备纯净、干燥的Cl2,其他药品与试剂任选。
(1)写出该反应的化学方程式。 (2)在下面方框中,A表示有分液漏斗和圆底烧瓶组成的气体发生器,请在虚线框内的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必
(2)在下面方框中,A表示有分液漏斗和圆底烧瓶组成的气体发生器,请在虚线框内的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必 画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如
画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如 下:
下: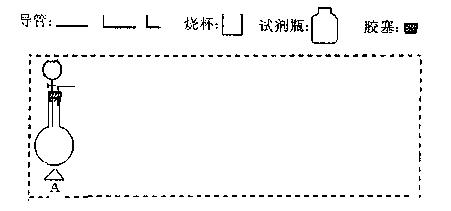
(3)根据方框中的装置图,完成下表(若无需填写,则在表格中写“无”)
| 仪器符号 |
仪器中所加物质 |
作用 |
| A |
MnO2、浓盐酸 |
MnO2与浓盐酸生成Cl2 |
(4)KMnO2与浓盐酸在常温下反应也可以得到Cl2,请写出该反应的离子方程式。
(5)请写出Cl2在工业、农业、医疗、卫生等方面的用途。(写出两种即可)
(6)将Cl2与SO4分别通人品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法。
某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
I.实验装置如下图l所示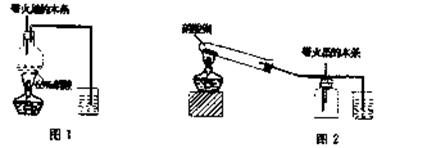
(1)浓硝酸受热分解的化学方程式是。
(2)实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确?——(填“正确,,或“不正确),理由是。
Ⅱ.实验装置如上图2所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式是
。
(2)当集气瓶中充满红棕色 气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?(填“正确”或“不正确”),理由是____。
气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?(填“正确”或“不正确”),理由是____。
III.为了更直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。