能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206.0 kJ/mol
Ⅱ.CO(g)+2H2(g)=CH3OH(g)ΔH=-129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_____。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如图。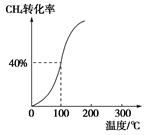
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________;
②100 ℃时反应Ⅰ的平衡常数为________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将1.0 mol CO与2.0 mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的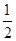 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
| A.c(H2)减小 |
| B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH的物质的量增加 |
D.重新平衡时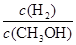 减小 减小 |
E.平衡常数K增大
(4)工业上利用甲醇制备氢气的常用方法有甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g) CO(g)+2H2(g),此反应能自发进行的原因是:___。
CO(g)+2H2(g),此反应能自发进行的原因是:___。
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程: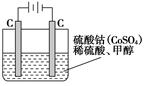
①写出阳极电极反应式_______________;
②写出除去甲醇的离子方程式___________________。
六种短周期元素,aA、bB、cC、dD、eE、fF,已知原子序数大小关系是:a<e<c<b<f<d,且a+b=(c+d)/2;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻。
(1)B、C、D三种元素形成的六原子核的化合物和水反应的离子方程式是:。
(2)A、C形成的四原子核化合物甲的电子式为,该化合物呈弱酸性,试写出这种化合物的电离方程式:。
(3)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式:。
(4)写出A、C、D形成的六原子核化合物乙的水溶液和甲的水溶液反应的化学方程式:。
(5)写出E和F形成的化合物和化合物A2C反应的化学方程式:。
(6)A、E形成的四原子核化合物丙容易液化,其原因是:。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: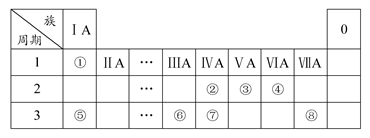
(1)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示);
②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示)。
(2)写出由以上某些元素构成的既含离子键、又含极性共价键的化合物的电子式(写出一种即可)。
(3)已知常温下1 g①单质在④单质中燃烧生成稳定的液态物质时放出142.9 kJ热量,则表示①单质燃烧的热化学方程式为。
(4)①②形成的最简单的化合物与④单质在KOH作电解质溶液时可形成原电池,其中负极的电极反应为。
(5)由表中元素①③④⑥⑧所形成的常见物质X、Y、Z、M、N可发生以下反应: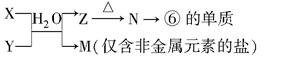
①X溶液与Y溶液反应的离子方程式为;
②N→⑥的单质所采用的方法是;
③M溶液呈酸性,原因是(用离子方程式解释)。
硫、氮、碳、铁、铜等常见元素在化合物中常表现出多种价态,如硫有-2、-1、+2、+4、+6等价态。这些元素在化工生产中有着重要应用。
(1)31.2g镁与碳粉的混合物在一定条件下恰好完全反应,再加入足量水,得到40.6g白色沉淀,同时产生密度为1.4107g/L(标准状况)的丙二烯和不饱和烃X的混合气体。
①镁与碳粉的反应产物的化学式为 ______________ 。
②原混合物中碳粉的物质的量分数为 ___________。(用小数表示,保留2位小数)
(2)某复杂盐由三种元素组成,含两种阳离子和两种阴离子。取21.76g该复杂盐,平均分为两份。将第一份溶于足量盐酸酸化的氯化钡溶液,所得沉淀中含9.32g硫酸钡。将第二份溶于足量热浓硝酸,再滴加足量硝酸钡溶液,得13.98g白色沉淀,过滤后向蓝色滤液中加足量烧碱溶液,过滤、洗涤、灼烧,得8.00g黑色固体。
①该复杂盐的化学式为_____________。
②该复杂盐中两种阳离子的质量比为 _________________ 。
(3)某地质学家经勘测发现一种新的磁黄铁矿,主要成分为Fe1-xS1+x,杂质不含Fe、S。分析可知该磁黄铁矿中,铁元素中三价铁的质量分数为75%。取5吨 73%的该磁黄铁矿,用接触法制硫酸,若沸腾炉中煅烧的损耗率为4%,接触室中反应的转化率为94%,SO3的吸收效率为97%,则最多可制得98.3%的浓硫酸的质量是________________。(保留2位小数)
舒林酸(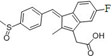 )广泛适用于各种关节炎以及各种原因引起的疼痛的临床治疗。它的一种合成路线如下:
)广泛适用于各种关节炎以及各种原因引起的疼痛的临床治疗。它的一种合成路线如下: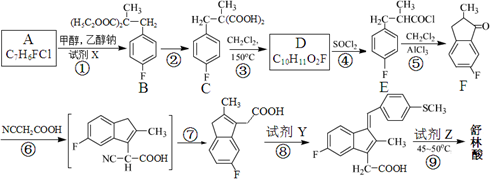
(1)反应条件:①对氟甲苯制备A:_______________;②反应②(彻底):______________________。
(2)有机物D的分子量最小的同系物的结构简式为_____________。(任写一种)
(3)反应类型:⑥__________、______________;⑨______________。
(4)符合下列条件的有机物F的同分异构体有__________种。
①能与氯化铁溶液发生显色反应;
②苯环上只有2种不同化学环境的氢原子;
③苯环上有2个侧链;
④与Br2发生1:1加成时,可得到3种加成产物。
(5)反应⑧的产物还有水,则试剂Y的结构简式为______________。
(6)利用舒林酸合成中的信息,写出实验室由以CH2(COOC2H5)2、1,4-二溴丁烷为原料(无机试剂、三碳以下的有机试剂等试剂任选)制备  的合成路线。
的合成路线。
(合成路线常用的表示方式为: )
)
有机酸除去羟基后余下的原子团(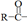 )称为酰基。傅-克酰基化反应、脱氢反应在合成稠环芳烃时起着很大的作用。萘、蒽、菲等稠环芳烃的合成均可说明这些反应的普遍性。
)称为酰基。傅-克酰基化反应、脱氢反应在合成稠环芳烃时起着很大的作用。萘、蒽、菲等稠环芳烃的合成均可说明这些反应的普遍性。
利用两次傅-克酰基化反应以及其他反应,由苯制备萘的反应过程如下:
已知:傅-克酰基化反应的1个实例: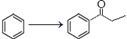 。
。
(1)羧酸脱水可形成酸酐,如:乙酸酐: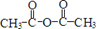 。则在流程I中,有机物W的名称为_____________。反应②中,试剂X是___________________ 。
。则在流程I中,有机物W的名称为_____________。反应②中,试剂X是___________________ 。
(2)在流程I中,属于傅-克酰基化反应的是__________________。(用①~⑤等编号表示)
蒽醌是合成一大类蒽醌燃料的重要中间体。与萘的合成原理类似,工业合成蒽醌,以及将蒽醌还原脱氢制备蒽的过程如下:
(3)反应⑥与反应①类似,请书写反应⑥的化学方程式:_______________________
(4)蒽醌的结构简式为:_______________________ 。
(5)书写反应类型:⑧_________________________。