汽车作为一种现代交通工具正在进入千家万户,汽车尾气的污染问题也成为当今社会急需解决的问题。为使汽车尾气达标排放,催化剂及载体的选择和改良是关键。目前我国研制的稀土催化剂催化转化汽车尾气示意图如图甲: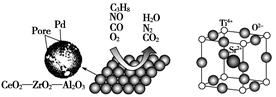
甲 乙
(1)下列有关说法正确的是________。
| A.C3H8中碳原子都采用的是sp3杂化 |
| B.O2、CO2、N2都是非极性分子 |
| C.每个N2中,含有2个π键 |
| D.CO的一种等电子体为NO+,它的电子式为[:N⋮⋮O:]+ |
(2)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍为0价,镍原子在基态时,核外电子排布式为_____________________;[Ni(CO)4]的配体是________,配位原子是________。
(3)Zr原子序数为40,价电子排布式为4d25s2,它在周期表中的位置是________。
(4)为了节省贵重金属并降低成本,也常用钙钛矿型复合氧化物催化剂。一种复合氧化物晶体结构如图乙,则与每个Sr2+紧邻的O2-有________个。
(6分)按要求填空:
(1)羟基的电子式是
(2)苯酚钠溶液中通入CO2的化学方程式:
(3)苯乙烯与溴的四氯化碳溶液的反应方程式:
(10分)(1)我国酸雨危害十分严重,是世界三大酸雨区之一,且主要为硫酸型酸雨。形成硫酸型酸雨主要是由于空气中含量超标。形成硫酸型酸雨发生的主要反应的化学方程式为
途径一:;
途径二:。
(2)某校科技活动小组的同学采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
| 时间 |
开始 |
8 h后 |
16 h 后 |
24 h后 |
32 h后 |
4O h后 |
48 h后 |
| pH |
5.O |
4.8 |
4.5 |
4.3 |
4.2 |
4.O |
4.O |
请根据上述材料,回答下列有关问题:
①酸雨放置时,pH发生变化的主要原因为
(3)你认为减少酸雨产生的途径可采取的措施是
A、用煤作燃料 B、把工厂烟囱造高 C、燃料脱硫 D、开发新能源
(1)写出乙醇和钠反应的化学方程式
(2) 写出FeCl3溶液与Cu单质反应的离子方程式
中学化学中几种常见物质的转化关系如下图所示:
将D溶液滴入沸水中可得到 以F为分散质的红褐色胶体。请回答下列问题:
以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体微粒直径大小的范围:__________。
(2)A、B、H的化学式:A________、B________、H________。
(3)①写出C的酸性溶液与双氧水反应的离子方程式:__________ ______________。
______________。
②写出鉴定E中阳离子的实验方法和现象:_________________________________。
③在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:
(6分)A、B、C、D、E 5种透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和 AgNO3中的一种,已知:①A与B反应有气体生成;②B与C反应有沉淀生成;
AgNO3中的一种,已知:①A与B反应有气体生成;②B与C反应有沉淀生成;
③C与D反应有沉淀生成;④D与E反应有沉淀生成;⑤A与E反应有气体生成;
⑥在②和③的反应中生成的沉淀为同一种物质
请填空:(1)写出各物质的化学式:A________,B________,C________,D________。
(2)A与E反应产生的离子 方程式为_____________________________。
方程式为_____________________________。