黑火药是中国古代四大发明之一,它的爆炸反应为:
2KNO3+3C+S A+N2↑+3CO2↑(已配平)。
A+N2↑+3CO2↑(已配平)。
(1)生成物中除了氮气与二氧化碳外,还有一种物质A,则A的电子式为 ,A属于________化合物。
(2)黑火药中位于元素周期表短周期的元素有 种。其中一种元素的单质可用于制药,其氧化物可用于漂白织物和作防腐剂,该元素在周期表中的位置是 。
(3)黑火药中所含元素的原子半径从大到小的顺序是 (用元素符号表示);
(4)下列事实能说明黑火药中碳与硫两元素非金属性相对强弱的有 。
A.同条件同浓度溶液的pH:Na2CO3>Na2SO4
B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
缓冲溶液可以抵抗少量酸或碱对溶液PH的影响。人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-),以维持血液PH的稳定。已知人体正常体温时,H2CO3 HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7则下列判断正确的是
HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7则下列判断正确的是
| A.正常人血液内Kw=10-14 |
| B.由题给数据可算得正常人血液的pH约为7.4 |
| C.正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) |
| D.当过量的碱进入血液中时,只发生反应:HCO3-+OH—=CO32-+H2O |
A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
| 物质组成 |
甲 |
乙 |
丙 |
丁 |
| 化合物中各元素 原子个数比 |
A和C 1:1 |
B和A 1:4 |
D和E 1:3 |
B和E 1:4 |
请回答下列问题:
⑴C的氢化物与乙相比较,稳定性强弱关系(用相应的化学式表示): _____>___
⑵元素E在周期表中的位置为第周期族
⑶请写出两种与乙具有相同电子数的非单核离子的化学式:_____和_____
⑷把D的单质放到NaOH溶液中,反应的化学方程式为:______________________
⑸写出甲的电子式:________________
⑹有200mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3 mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是: _____
Ⅰ.下列各项分别与哪个影响化学反应速率因素的关系最为密切?
⑴夏天的食品易变霉,在冬天不易发生该现象_________
⑵同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢
⑶MnO2加入双氧水中放出气泡更快______________。
Ⅱ.在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
⑴比较t2时刻,正逆反应速率大小V正____ V逆。(填“>”、“=”、“<”)
⑵若t2 =2min,计算反应开始至t2时刻,M的平均化学反应速率为:________
⑶t3时刻化学反应达到平衡时反应物的转化率为_________
⑷如果升高温度则V逆____(填增大、减小或不变)
Ⅰ.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的某性质)
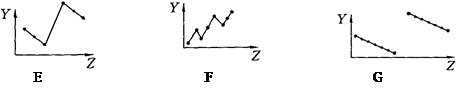
把与下面元素有关性质相符的曲线标号填入相应括号中:
⑴ⅡA族元素的最外层电子数 ( )⑵第三周期元素的最高化合价()
⑶第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径()
⑷第二、三周期元素随原子序数递增原子半径的变化(不包括惰性气体) ()
⑸碱金属的阳离子氧化能力(不包括钫)()
Ⅱ.下图是元素周期表的一部分
 |
|||||||||||||||||
⑴请在表中画出金属与非金属的交界线⑵请在表中标出第VIII的位置
⑶在表中标出 的位置
的位置
下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4500ml的操作,请按要求填空:
(1)所需浓H2SO4的体积为
(2)如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将(偏高、偏低、无影响)。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的里,并不断搅拌,目的是。
(4)将的上述溶液沿注入中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要中,并摇匀。
(5)加水至距刻度处,改用加水,使溶液的凹液面正好跟刻度相平。