当归素是一种治疗偏头痛的有效新药。以下是某研究小组开发的生产当归素的合成路线。
已知:①A的相对分子质量为104,1 mol A与足量的碳酸氢钠反应生成44.8 L气体(标准状况);
②B的结构中含有醛基;
③C在一定条件下生成有机酸D;
④RCHO+HOOC—CH2COOH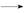 RCH
RCH C(COOH)2+H2O、RCH
C(COOH)2+H2O、RCH C(COOH)2
C(COOH)2 RCH
RCH CHCOOH+CO2↑。
CHCOOH+CO2↑。
请回答下列问题。
(1)A的分子式是 ,B的结构简式为 。
(2)C可能发生的反应是 (填序号)。
| A.氧化反应 | B.水解反应 |
| C.消去反应 | D.酯化反应 |
(3)反应②的化学方程式为 。
(4)E的名称为 。
(5)符合下列条件的D的同分异构体共有 种,其中在核磁共振氢谱中只出现五组峰的物质的结构简式为 。
①苯环上只有两个取代基;
②苯环上的一氯代物只有两种;
③1 mol该同分异构体与足量的碳酸氢钠反应生成2 mol CO2。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
(2)漂白粉的主要成分(填化学式)有效成分是(填化学式)。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方为。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)。
(8分)(1)49 g硫酸的物质的量为mol,若在水中完全电离可产生molH+ , ______mol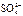 .若有一定量的硫酸完全电离产生
.若有一定量的硫酸完全电离产生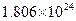 个
个 ,此硫酸的质量为 _______g.
,此硫酸的质量为 _______g.
(2)标准状况下,11.2L的H2S气体质量为17g,则H2S的摩尔质量是,相对分子质量为; 等物质的量的NH3与H2S质量比为; 1.7g氨气与mol H2O含有的电子数相等。
已知,卤代烃中的卤族元素在强碱溶液中可以被羟基取代。有机物A—H能发生下图所示一系列变化。按下列各要求填写
(1)写出结构简式:
ABCD
(2)写出所标反应的化学方程式:
①
②
(3)写出下列序号发生的化学反应类型:②③
(4)C、G、H中与等物质的量的乙炔燃烧消耗的氧气相同的化合物是(填字母)
工业上生产硫酸时,将SO2氧化为SO3是关键一步。
(1)某温度下,SO2(g)+1/2O2(g)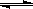 SO3(g);△H="—98" kJ·mol—1。开始时在 10L的密闭容
SO3(g);△H="—98" kJ·mol—1。开始时在 10L的密闭容
器 中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=。
中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=。
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)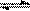 2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是。
2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是。
| A.保持温度和容器体积不变,充入2mol SO3 |
| B.保持温度和容器体积不变,充入2mol N2 |
| C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2 |
| D.保持温度和容器内压强不变,充入1mol SO3 |
E.升高温度F.移动活塞压缩气体
(3)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:。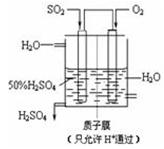
(4)在0.1mol·L-1的(NH4)2SO4溶液中,离子浓度由大到小的顺序是。
某烃的相对分子质量为114,该烃的分子式为__________;它的主链碳原子数最少且其一氯代物只有一种的烃的结构简式为____________;其一种同分异构体对应的单烯烃只有两种,则此异构体的结构简式为_____________;对应的两种烯烃名称为________和________ 。