X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期。下列说法错误的是( )
| A.Y、Z、R 3种元素组成的化合物水溶液一定显碱性 |
| B.原子半径:Z>R>W |
| C.气态氢化物稳定性:HW>H2R |
| D.XW4分子中各原子均满足8电子结构 |
我国支持“人文奥运”,坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )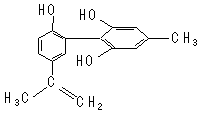
| A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 |
| B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C.该分子中的所有原子有可能共平面 |
| D.1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol |
某烃的结构简式为CH3―CH2―CH=C(C2H5)―C≡CH分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数量最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别为 ( )
| A.4、3、5 | B.4、3、6 | C.2、5、4 | D.4、6、4 |
下列实验能够成功的是 ( )
| A.只用溴水一种试剂可鉴别甲苯、己烯、乙醇、四氯化碳四种液体 |
| B.用苯和溴水在Fe催化下可制的溴苯 |
| C.用乙醇、冰醋酸和pH=1的H2SO4溶液混合加热可制备乙酸乙酯 |
| D.用酚酞可鉴别苯酚钠和乙酸钠两种溶液 |
从苯酚的乙醇溶液中回收苯酚的实验中,操作步骤合理的是( )
①蒸馏
②过滤
③静置分液
④加入足量钠
⑤通入足量CO2
⑥加入足量NaOH溶液
⑦加入乙酸和浓硫酸的混合液加热
| A.④⑤③ | B.⑥①⑤③ | C.⑥⑤①② | D.⑦① |
2008年北京奥运会的国家游泳中心(水立方)的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成聚全氟乙丙烯。下列说法错误的是 ( )
| A.合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应 |
| B.ETFE分子中可能存在“—CH2—CH2—CF2—CF2—”的连接方式 |
C.聚全氟乙丙烯分子的结构简式可能为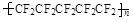 |
| D.四氟乙烯分子中含有共价键 |