甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)反应②是 (填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
(4)甲醇燃料电池有着广泛的用途,同时Al-AgO电池是应用广泛的鱼雷电 池,其原理如图所示。该电池的负极反应式是 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为 。
把N2和H2以1:1的物质的量比混合后分成四等份,分别同时充入A、B、C、D四个装有催化剂的真空容器中(四个容器的容积固定,且不等),在保持相同温度的条件下,四容器中的合成氨反应相继达到平衡状态。分析表中的实验数据后回答有关问题((2)(3)小题用A、B、C、D填空)。
| 容器代码 |
A |
B |
C |
D |
平衡时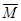 (混) (混) |
16 |
17 |
||
| 平衡时N2转化率 |
20% |
① |
② |
③ |
| 平衡时H2转化率 |
30% |
(1)①②③分别为、、。
(2)都达到平衡时,容器的NH3的物质的量所占的比例最大。
(3)四个容器的容积由小到大的顺序是。
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑵硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,该族2 … 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
⑶用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:______________;
已知水在25℃和99℃时,其电离平衡曲线如右图所示:
(1)则25 时水的电离平衡曲线应为______(A或B)。
(2)25时,将=9的NaOH溶液与=4的H2SO4溶液混合,若所得混合溶液的=7,则NaOH溶液与H2SO4溶液的体积比为____________。
(3)99时,若100体积1=的某强酸溶液与1体积
2=b的某强碱溶液混合后溶液呈中性,则混合前,与b之间应满足的关系是____________________。
25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示):
___________________________________________________________________;
(2)混合溶液中由水电离出的c(H+)_____(填“<”“>”“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);
(3)求出混合液中下列算式的精确计算结果:
c (Na+)-c (A-)=______________mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH_____7 (填“<”“>”“=”);
(5)将相同温度下相同浓度的五种溶液:
①(NH4)2CO3②NH3·H2O③(NH4)2SO4④NH4Cl⑤CH3COONH4
按c(NH4+)由大到小的顺序排列___________________(填序号)。
已知:A酸的溶液pH=a,B碱的溶液pH="b"
(1)若A为盐酸,B为氢氧化钠,且a+b=14,二者等体积混合,则溶液的pH=。若酸碱按体积比为1:10混合后溶液显中性,
则a+b=。
(2)若A为醋酸,B为氢氧化钡,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为mol·L-1,B溶液中水电离出的氢离子浓度为。mol·L-1
(3)若A为醋酸,B为氢氧化钠,且a+b=14,将体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA VB,
混合后溶液中的离子浓度关系为c(Na+) c(CH3COO-)
(填“<”“>”或“=”)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,
其水解反应的离子方程式为。