科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为 。要清洗附着在试管壁上的硫,可用的试剂是 。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。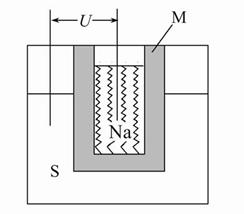
与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 __ 倍。
(3)Na2S溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体CuSO4,溶液pH (填“增大”、“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为 (用离子方程式表示)。
25℃时,1L 0.01mol/LHCl溶液,水的离子积常数Kw为,溶液中H+的物质的量浓度为,水电离出的H+的物质的量浓度为,向上述溶液中加入1L 0.008mol/L的NaOH溶液,反应后溶液的pH为。
(10分)某离子晶体晶胞的结构如图所示。X(·)位于立方体顶点,Y(o)位于立方体中心。试分析:
(1)晶体中每个Y同时吸引着________个X,每个X同时吸引着________个Y,该晶体的化学式为________。
(2)晶体中每个X周围与它最接近且距离相等的X共有________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是________。
(4)设该晶体的摩尔质量为Mg/mol,晶体密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心距离为________cm。
根据下列某些短周期元素中元素性质的有关信息,回答下列问题:
| ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
| 原子半径 /10-10m |
0.37 |
1.86 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.52 |
0.75 |
0.71 |
| 最高价态 |
+1 |
+1 |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
||
| 最低价态 |
-1 |
-2 |
-4 |
-3 |
-1 |
-3 |
-1 |
(1)元素①②⑧的第一电离能由大到小的顺序是 ;元素③⑥⑨的电负性由大到小的顺序是 (以上均用元素符号填空)。
(2)元素⑤⑥⑦中的某两种形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有 (写化学式)。
(3)某元素R 的原子半径为1.02×10-10m,它与钠形成Na2R2,若物质Na2R2是一种含有非极性共价键的离子化合物,其电子式是 (R用元素符号表示)。
(4)元素①和⑨形成阳离子,其结构式为 ,其中心原子以 杂化轨道成键。
(5)元素⑤的原子基态电子排布式为 。
氮元素可以形成多种化合物。
回答以下问题:
(1)基态氮原子的价电子排布式是 。
(2)C、N、O三种元素第一电离能从大到小的顺序是 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被——NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是 ;N2H4分子中氮原子轨道的杂化类型是 。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g)△H=-1 038.7 kJ·mol-1
若该反应中有4 mol N-H键断裂,则形成的π键有 mol。
③肼能与硫酸反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在 (填标号)。
a.离子键 b.共价键
c.配位键d.范德华力
下表为周期表的一部分,其中的编号代表对应的元素。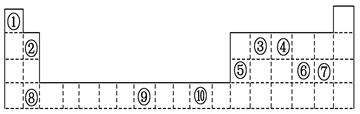
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)写出元素⑨的基态原子的电子排布式 。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为 对。
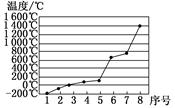
(4)第3周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图中的序号)。