Ⅰ.利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。用乙烯作为还原剂将氮的氧化物还原为N2是燃煤烟气的一种脱硝(除NOx)技术。其脱硝机理如图所示。写出该脱硝过程中乙烯和NO2反应的化学方程式 。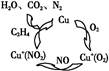
Ⅱ.(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 (填“增大”、“减小”或“不变”,下同),ΔH的变化是 。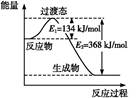
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH="+49.0" kJ·mol-1;
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g)ΔH="-192.9" kJ·mol-1。
O2(g)=CO2(g)+2H2(g)ΔH="-192.9" kJ·mol-1。
又知③H2O(g)=H2O(l) ΔH="-44" kJ·mol-1。
则甲醇蒸气完全燃烧生成液态水的热化学方程式为 。
写出甲醇质子交换膜燃料电池在酸性条件下的负极反应式: 。
有机物X、Y、Z都是芳香族化合物, X与Z互为同分异构体,Y的分子式为C9H8O,试回答下列问题。
(1)X是一种重要的医药中间体,结构简式为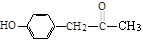 ,X可能发生
,X可能发生
的反应有___________________。
a.取代反应 b.消去反应 c.氧化反应 d.水解反应
(2)有机物Y有如下转化关系: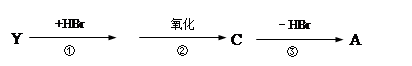
其中Y不能跟金属钠反应;A能跟NaHCO3溶液反应,能使溴的四氯化碳溶液褪色,且苯环上只有一个取代基。
Y的结构简式为______________________或_________________________。
(3)Z可由A经一步反应制得。
① Z的结构简式为______________________或_________________________;
② Z有多种同分异构体,其中属于饱和脂肪酸的酯类,且苯环上只有一个侧链
的同分异构体有 、__________________________、
、__________________________、
_________________________________、_____________________________。
(1)题每空1分,其余每空2分,共12分)物质A是化合物,B、C、D、K都是单质,反应②~⑤都是常见的工业生产的反应,各有关物质之间的相互反应转化关系如下图所示: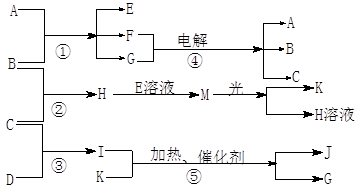
请填写下列空白:
(1)写出下列物质的化学式:B ; C; D;
K;G;J。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M。
②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为
。
(每空2分,共14分)A、B、C、D、E、F六种中学化学中常见的物质,有如图转化关系,则: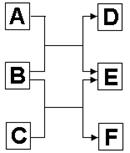
(1)若A、C、E皆为氧化物,且E为有毒气体,B、D、F皆为非金属单质,且D为气体。则A的结构简式为,单质F的晶体类型为,1molC中含有个共价键。
(2)若A、C、E皆为氢化物,三者皆为极性分子,其中C的相对分子质量最小;D、E、F皆为氧化物,其中D、F为有毒气体,F遇空气变为红棕色则。
①A、C、E沸点由高到低的顺序为,(填化学式);A、C、E三种气态氢化物稳定性最强的是(填化学式)。
②B跟C反应生成E和F的化学方程式为。
③A跟D常温下反应可生成一种单质,化学方程式为。
((2)题每空3分,其余每空2分,共12分)A、B、C、D均为中学化学常见的物质,它们之间的反应关系如下图:
回答下列问题:
(1)若A是可溶性的强碱,B是酸式盐,D不溶于稀硝酸,则B的化学式为________________,有关的离子方程式为___________________________________。
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液。
①若C为能使澄清石灰水变浑浊的无色无味气体,该反应的离子方程式为
____________________________________________________。
②若A是一种淡黄色固体,且A与B以物质的量之比3∶1混合时,推知B的化学式为
__________。
(3)若B为Ca(HCO3)2溶液,A与B的溶液反应时只生成气体C、CaCO3和水,则A的化学式为__________________。
(每空2分,共16分)短周期元素X、Y、Z、W,原子序数依次增大。常温常压下,只有W的单质为气体。它们的最高氧化物对应的水化物依次为甲、乙、丙、丁。甲、乙、丙是中学化学中的常见物质,其中只有乙难溶于水,且能和甲、丙反应得到澄清溶液。根据以上信息填写下列空白:
⑴画出W的原子结构示意图_________________________________________;
⑵将乙和甲、丙分别反应后得到的溶液混合,观察到的现象是___________________
___________________,两溶液混合时所发生反应的离子方程式为____________________________________________________;
⑶下列事实能证明Z和W非金属性强弱的是(选填序号)__________________________;
| A.单质的熔点:Z>W2 |
| B.酸性:丁>丙 |
| C.在溶液中:W2+H2Z=2HW+Z |
| D.稳定性:HW>H2Z |
E.氢化物水溶液的酸性:HW>H2Z
F.溶解性:丁>丙
⑷用Y单质和生活中最常用的金属作电极,用导线连接插入甲的溶液中构成原电池,该原电池负极的电极反应式为_______________________________________________;
⑸工业上以XW为原料可以进行许多化生产,甲和W2都是其主要产品。写出工业上以XW为原料生产甲和W2的化学方程式_______________________________________________
_______________________________________________;若要生产80.0 kg甲物质,至少需要XW______________kg,同时可得W2_____________m3(标况)。