二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 。
②实验过程中,需要通入氧气。试写出一个用如图所示装置制取氧气的化学方程式 。
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
对羟基苯甲醛,俗称PHBA,是-种重要的有机化工原料。其结构如图所示。有人提出,以对甲基苯酚为原料合成PHBA的途径如下: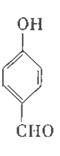
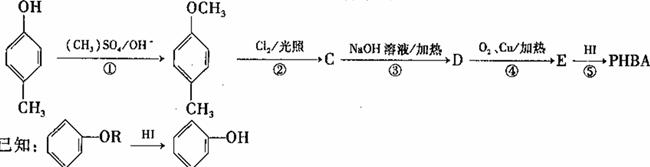 (1)PHBA的官能团的名称为_______。
(1)PHBA的官能团的名称为_______。
(2)下有关PHBA的说法正确的是_______。
| A.PHBA的分子式为C7H6O2 | B.PHBA是一种芳香烃 |
| C.1mo1PHBA最多能与4mo1H2反应 | D.PHBA能与NaHCO3溶液反应生成CO2 |
(3)上述反应中属于取代反应的_______。
(4)反应③的化学方程式为_______。
(5)该合成途径中的反应①⑤的作用为_______。
(6)E有多种同分异构体,符合以下所有特征的同分异构体的结构简式为______ (只写一种)。
a.苯环上存在2种不同化学环境的氢原子,且个数比为1:2
b.遇FeCL3 溶液显示特征颜色
c.能使溴的四氯化碳溶液褪色
I.S4N4的结构如图: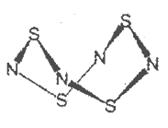
(1)S4N4的晶体类型是___。
(2)用干燥的氨作用于S2Cl2的CCl4,溶液中可制S4N4,化学反应方程为:6S2Cl2+16NH3=S4N4+S8+12NH4Cl
①上述反应过程中,没有破坏或形成的微粒间作用力是___;
a离子键;b极性键;c非极性键;d金属键;e配位键;f范德华力
②S2Cl2中,S原子轨道的杂化类型是___。
II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图: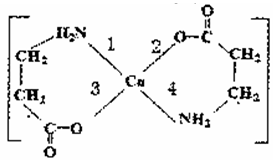
(3)基态Cu2+的外围电子排布式为__。
(4)二甘氨酸合铜( II)中,第一电离能最大的元素与电负性最小的非金属元素可形成多种微粒,其中一种是5核10电子的微粒,该微粒的空间构型是_。
(5)lmol二甘氨酸合铜(II)含有的二键数目是_。
(6)二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是____ (填写编号)。
无水硝酸铜极易吸水,加热到210℃升华,它和Cu(NO3)2 ·3H2O晶体的化学性质有较大差异, Cu(NO3)2 ·3H2O晶体加热到170℃分解。已知:乙酸乙酯的沸点为77 ℃。
(1)加热蒸干Cu(NO3)2 溶液得不到无水硝酸铜的原因是_____________。
(2)将铜片加人到N2 O 4的乙酸乙酯溶液中可制得无水硝酸铜,同时生成NO,写出反应的化学方程式_____________;从乙酸乙醋中分离出无水硝酸铜的实验操作是_____________。
(3)为探究Cu(NO3)2 ·3H2O受热分解的产物,某探究小组利用下图装置进行实验。(图中夹持和加热装置去)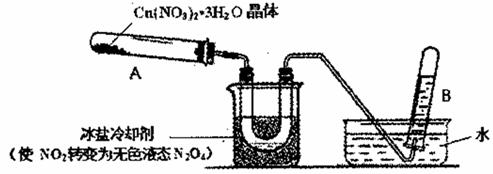
往试管A中加人研细的Cu(NO3)2 ·3H2O体并加热,观察到试管A中有红棕色气生成,最终残留黑色粉末;U型管中有液体生成,在试管B中收集到无色气体。
①当导管口不再有气池冒出时,反应停止,拆除装置的操作首先是______。
②试管B中收集到的气体一定含有______。
(4)锌与Cu(NO3)2溶液能发生反应。在一支试管中注人1 mol·L-1的Cu(NO3)2溶液,再放入一块锌片,观察到在反应初期有大量无色气泡冒出,同时锌片上析出红色固体。该小组猜想气体的成分,并设计的实验步骤,请填写下表。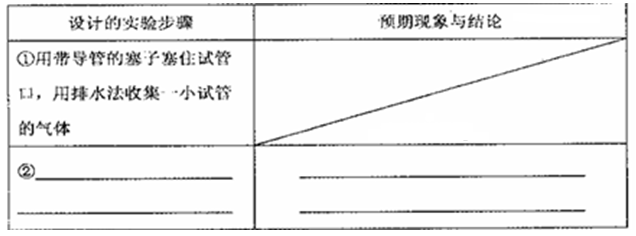
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺:将处理过的黄铜矿加人石英,再通人空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为:2CuFeS2 + 2SiO2+5O2=2Cu+2FeSi03+4SO2该反应的氧化剂是_____。
(2)下列处理SO2的方法,不合理的是_____
| A.高空排放 |
| B.用纯碱溶液吸收制备亚硫酸钠 |
| C.用氨水吸收后,再经氧化制备硫酸铵 |
| D.用BaCl2溶液吸收制备BaSO3 |
(3)炉渣主要成分有FeO 、Fe2O3 、SiO2 ,Al2O3等,为得到Fe2O3加盐酸溶解后,后续处理过程中,未涉及到的操作有_____。
A过滤;B加过量NaOH溶液;C蒸发结晶;D灼烧;E加氧化剂
II.FeCl3溶液浸取工艺:其生产流程如下图所示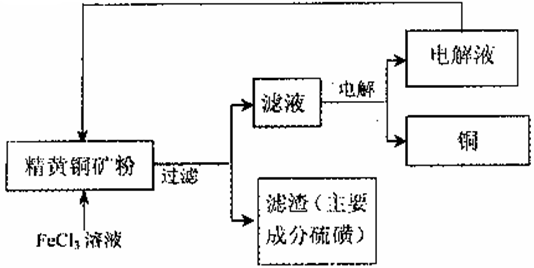
(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为_____________。
(5)该工艺流程中,可以循环利用的物质是_____(填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时溶液中Pb2+物质的量浓度为__mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
碳及其化合物应用广泛。
I.工业上利用CO和水蒸汽反应制氢气,存在以下平衡:CO(g)+H2O(g) 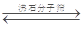 CO2(g)+H2(g)
CO2(g)+H2(g)
(1)沸石分子筛中含有硅元素,请写出硅原子结构示意图__________。
(2)向1L恒容密闭容器中注人CO和H2o(g),830℃时测得部分数据如下表。则该温度下反应的平衡常
数K=______________。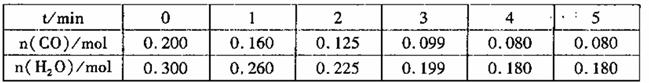
(3)相同条件下,向1L恒容密闭容器中,同时注人1mol CO、1mol H2O(g),2molCO2和2mo1 H2,此时v(正 ) __________v(逆)(填“>”“=”或“<”)
II.已知CO(g)+1/2 O2 (g)=CO2 (g)△H=一141 kJ·mol-1
2H2(g)+ O2(g)=2H2O(g)△H=一484 kJ·mol-1
CH3OH(1)+3/2O2 (g)=CO2(g)+2H2O(g)△Hl=一726 kJ·mol-1
(4)利用CO、H2化合制得液态甲醇的热化学方程式为___________。
III.一种新型氢氧燃料电池工作原理如下图所示
(5)写出电极A的电极反应式_____________。
(6)以上述电池电解饱和食盐水,若生成0.2mo1 Cl2,则至少需通人O2的体积为_____L(标准状况)。