A、B、C、D、E是中学阶段常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的转化关系如图所示:
(1)X的单质与A反应的化学方程式是_______________________________。
(2)若试剂1是NaOH溶液,则X的单质与试剂1反应的离子方程式是
___________________________________
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是___________________________________。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)
________________________________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的,工业上以E、稀硫酸和亚硝酸钠为原料制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是_____________________。
已知20℃时NaCl的溶解度为36 g。某氯碱厂使用的设备是阳离子交换膜电解槽,若一次向电解槽中加入一定量20℃时饱和NaCl溶液,当90%的NaCl电解时,阴极收集到11. 2 m3气体(已折算成标准状况)。请回答下列问题:
(1)该反应的离子方程式为。
(2)取阳极区溶液作系列实验,下列结论中错误的是。(填字母)
| A.滴加酚酞试剂,先变红后褪色 | B.滴加硝酸银溶液,有白色沉淀产生 |
| C.滴加小苏打溶液,有气泡产生 | D.做焰色反应实验呈黄色 |
(3)计算原饱和NaCl溶液的质量kg(精确到0.1kg)。
(4)若电解90%的NaCl所需电能是由甲烷燃料电池提供,则所需甲烷至少m3?
(甲烷的电极反应式:CH4+10OH--8e— = CO32—+7H2O
假设该燃料电池的能量利用率为90%。折算成标准状况。精确至0.1 m3)
I.A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同。已知:2NO2(g) N2O4(g)△H<0。
N2O4(g)△H<0。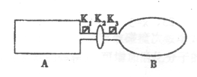
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是V(A)V(B)(填“<”、“>”或“=”);若打开活塞K2,气球B将(填“变大”、“变小”或“不变”,下同)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将。
若通入等量的Ne气,则达到平衡时,A中NO2的转化率将,B中NO2的转化率将
(3)室温时,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的压强为原来的80%,试求出平衡时NO2的转化率。
II.已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1,c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为。
③若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,c(N)=amol·L-1;达到平
衡后,c(P)="2" mol·L-1,a=mol·L-1。
工业上制备BaCl2的工艺流程图如下: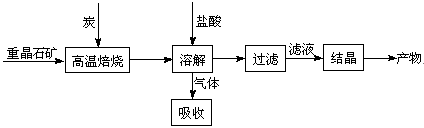
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s)△H1 ="+" 571.2 kJ·mol-1①
4CO(g) + BaS(s)△H1 ="+" 571.2 kJ·mol-1①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s)△H2=" +226.2" kJ·mol-1②
2CO2(g) + BaS(s)△H2=" +226.2" kJ·mol-1②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,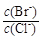 =。
=。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是,。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。

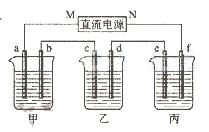
 (1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。
据此回答问题: ①电源的N端为极;
①电源的N端为极; ②电极b上发生的电极反应为;
②电极b上发生的电极反应为; ③电极b上生成的气体在标准状况下的体积:
③电极b上生成的气体在标准状况下的体积:
 ④电极c的质量变化是g;
④电极c的质量变化是g; (2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? 。
。 ⑤电解前后各溶液的pH如何变化。(填增大,减小或不变)
⑤电解前后各溶液的pH如何变化。(填增大,减小或不变) 甲溶液;
甲溶液; 乙溶液_______;
乙溶液_______; 丙溶液_______;
丙溶液_______;
25℃,NaOH和Na2CO3两溶液的pH均为11.
(1)两溶液中,由水电离出得c(H2O)分别是①NaOH中,②Na2CO3中,③在1L水中加入上述会使水的电离程度减小。
(2)各取10mL上述两种溶液,分别加水冲稀到100mL,pH变化较大的是,(填化学式)溶液。
(3)现有0.1mol/L的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是,你认为该溶液pH的范围一定介于之间。