红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中做辅助剂,在化学工业和制药工业中也可做氧化剂,应用领域十分广泛。实验室中红矾钠可用一种铬铁矿(主要成分:FeO·Cr2O3,还含有少量的Al2O3)通过以下过程来制取。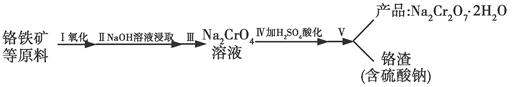
回答下列问题:
(1)步骤Ⅰ中反应化学方程式为4FeO2·Cr2O3(s)+8Na2CO3(s)+7O2(g)=8Na2CrO4(s)+2Fe2O3(s)+8CO2(g)。
①在实验室,步骤Ⅰ应在________(填“陶瓷”或“铁”)坩埚中完成。
②在常温下该反应速率极慢,下列措施中能使反应速率增大的是________(填字母)。
A.将原料粉碎 B.增加纯碱的用量 C.升高温度
(2)步骤Ⅱ中NaOH的作用是________________________(用化学反应方程式表示)。
(3)步骤Ⅳ中发生反应的离子方程式为________;反应完成的标志是________。
(4)利用下面的复分解反应,将红矾钠与KCl固体按12物质的量之比混合溶于水后经适当操作可得到K2Cr2O7晶体:Na2Cr2O7+2KCl=K2Cr2O7+2NaCl(已知:温度对氯化钠的溶解度影响很小,对重铬酸钾的溶解度影响较大)
基本实验步骤为①溶解;②________;③________;④冷却,结晶,再过滤得K2Cr2O7晶体。其中③应在________(填“高温”或“低温”)条件下进行。
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)氧化性最弱的简单阳离子的结构示意图是。
(3)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式。
(4)Na2S溶液长期放置有硫析出,原因为(用离子方程式表示)。
(5)已知:2SO2(g)+O2(g) 2SO3(g)平衡常数为K1
2SO3(g)平衡常数为K1
2NO(g)+O2(g) 2NO2(g)平衡常数为K2
2NO2(g)平衡常数为K2
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的平衡常数为K3=(用K1、K2来表达)
SO3(g)+NO(g)的平衡常数为K3=(用K1、K2来表达)
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO2和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=。
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式。
元素周期表中ⅣA族元素(C、Si、Ge、Sn、Pb)的单质及其化合物的用途广泛。
(1)在ⅣA族元素中,其最高价氧化物对应水化物酸性最强的是______(填化学式),简单气态氢化物沸点最低的是_____________(填化学式)。
(2)金刚砂(SiC)的晶体结构与金刚石、晶体硅类似,它们均为____晶体,其中熔沸点最低的是____(填名称)。
(3)焦炭可用于制备电石、生产水煤气等,电石的主要成分是CaC2,CaC2的电子式是___________;制备电石还需要用到CaCO3。组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为____________(填元素符号)。
(4)甲硅烷(SiH4)是一种无色的液体,遇到空气能发生爆炸性自燃,生成二氧化硅固体和水。在室温下,10g SiH4燃烧放出热量446kJ,请写出其燃烧的热化学方程式:。
(5)铅是一种金属元素,可用作蓄电池的材料,其合金可作铅字、轴承、电缆包皮之用,还可做体育运动器材铅球等。配平下列化学反应方程式,把系数以及相关物质(写化学式)填写在空格上, 并标出电子转移的方向和数目。
______PbO2+_____MnSO4+_____HNO3=___HMnO4+___Pb(NO3)2+___PbSO4↓+____
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道接受NH3分子提供的形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。
a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为(用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于。
有W、X、Y、Z四种原子序数依次增大的元素。已知:
①W与X或Y形成的化合物的焰色反应均呈黄色
②X原子次外层电子数为核外电子总数的一半
③X离子、Y离子均与Y的气态氢化物具有相同电子数
④Z的3d轨道上有电子,可与Y组成化合物ZY2和ZY3
请回答:
(1)W是,X是,Y是。(填元素符号)
(2)Z元素在元素周期表中的位置是第周期族,Z3+的核外电子排布式为:。
(3)W2X的电子式为。
现有几组物质的熔点(℃)数据:
| A组 |
B组 |
C组 |
D组 |
| 金刚石:>3 550 |
Li:181 |
HF:-84 |
NaCl:801 |
| 硅晶体:1 410 |
Na:98 |
HCl:-115 |
KCl:776 |
| 硼晶体:2 300 |
K:64 |
HBr:-89 |
RbCl:718 |
| 二氧化硅:1 723 |
Rb:39 |
HI:-51 |
CsCl:645 |
据此回答下列问题:
(1)A组属于________晶体,其熔化时克服的粒子间的作用力是________。
(2)B组晶体共同的物理性质是________(填序号)。
①硬度大②导电性③导热性④延展性
(3)D组晶体可能具有的性质是________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(4)D组晶体的熔点由高到低的顺序为:NaCl>KCl>RbCl>CsCl,其原因解释为:。