A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。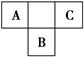
(1)写出A、B、C三元素名称______、______、______。
(2)C在元素周期表中的位置是_____________________________________。
(3)B的原子结构示意图为________,C的氢化物与B的氢化物的稳定性强弱顺序为________>________(填化学式)。
(4)比较A、C的原子半径:A________C,写出A的气态氢
化物与A的最高价氧化物对应水化物反应的化学方程式:___________________________。
甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如图所示,又知:
①甲、乙、丙均为前三周期元素的单质,常温下均为气态,
丁是日常生活中的一种常见金属;
②常温下,X是无色液体,Y是黑色固体;
③丙在乙中燃烧发出苍白色的火焰,丁在乙中燃烧生成棕黄色
的烟,W的水溶液呈黄色。
回答下列问题:
(1) 写出下列物质的化学式: X W
(2)将乙单质通入紫色石蕊试液中,看到的现象是 。
(3)写出丁单质与Z的水溶液反应的化学方程式 。
(8分)下表列出了①~⑥六种元素在元素周期表中的位置。
 族 族周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
请回答下列问题:
(1) ①、②、③三种元素相比较,非金属性最强的是(填写元素符号);
(2) 元素②和⑥的氢化物中,稳定性较强的是(填氢化物的分子式);
(3) ①的最高价氧化物对应的水化物的化学式为 ;
(4)④、⑤两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是
。
(8分)为提高人体素质, 避免人体缺碘影响正常的生命活动,我国早已采取食盐加碘措施。据报道, 人从食物中摄取碘后碘便在甲状腺中积存下来, 通过一系列化学反应可形成甲状腺素。甲状腺素的结构如下图,回答下列问题: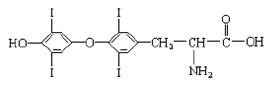
(1)甲状腺素由________种元素组成;
(2)“加碘食盐”中的碘元素以碘酸钾(KIO3 )的形式存在 , KIO3中碘的化合价是,我们用稀盐酸和淀粉KI试纸可以检验食盐中碘酸钾的存在,实验现象是。
(3)在“加碘食盐”包装袋上有“烹调时,待食品熟后加入碘盐” 文字说明,由此可推测碘酸钾在受热时容易。
(4分) 将钠在空气中燃烧,产物的化学式为 ;某无色气体与空气接触后,气体的颜色由无色变成红棕色,则原气体为 。
(6分) 在氮的单质和常见化合物中:
(1)常用作保护气(如填充灯泡、焊接保护等)的物质是;
(2)能与酸反应生成盐,在常温下为气态的物质是;
(3)在通常状况下是晶体,易溶于水,可以作氮肥,遇碱会放出带刺激性气味气体。写出它们与NaOH等强碱溶液反应的离子方程式。