已知A元素原子核外电子共占有5个轨道且有2个成单电子;B元素原子核外能量最高电子为:n=3、l=1、m=1、ms=+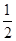 ,n=3、l=1、m=0、ms=+
,n=3、l=1、m=0、ms=+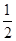 。则A、B两元素所形成化合物的晶体类型为( )。
。则A、B两元素所形成化合物的晶体类型为( )。
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O=O dkJ·mol—1。
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
| A.(4c+12b-6a-5d)kJ·mol—1 |
| B.(6a+5d-4c-12b)kJ·mol—1 |
| C.(4c+12b-4a-5d)kJ·mol—1 |
| D.(4a+5d-4c-12b)kJ·mol—1 |
下列离子方程式中正确的是
| A.氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2= HCO3- |
| B.亚硫酸氢铵溶液与足量氢氧化钠溶液反应 HSO3-+ OH-= SO32-+ H2O |
| C.氯气通入冷水中 Cl2+H2O = Cl- +ClO- +2H+ |
| D.碳酸镁悬浊液中加醋酸 CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O |
在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是,
| A.pH=3的硝酸和pH=11的氢氧化钠溶液 |
| B.pH=3的盐酸和pH=11的氨水 |
| C.pH=3的硫酸和pH=11的氢氧化钠溶液 |
| D.pH=3的醋酸和pH=11的氢氧化钠溶液 |
等物质量浓度的HCN溶液与NaCN溶液等体积混合,混合液显碱性,下列说法错误的
| A.c(CN—) >c(Na+)>c(H+)>c(OH-) |
| B.c(Na+)>c(CN—)>c(OH-)>c(H+) |
| C.c(Na+)+ c(H+)= c(CN—)+ c(OH—) |
| D.2c(OH—)+ c(CN—)=2c(H+)+c(HCN) |
某学生欲完成反应Cu+H2SO4===CuSO4+H2↑而设计了下列四个实验,你认为可行的是