Ⅰ.自从英国化学家巴特列(N.Bartlett)首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。
(1)请根据XeF4的结构示意图(图1)判断这个分子是极性分子还是非极性分子?____________________。
(2)XeF2晶体是一种无色晶体,图2为它的晶胞结构图。XeF2晶体属于哪种类型的晶体?__________________。
Ⅱ.已知有关物质的熔、沸点数据如下表:
| 物质 |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
| 熔点/℃ |
2 852 |
2 072 |
714 |
190(2.6×105Pa) |
| 沸点/℃ |
3 600 |
2 980 |
1 412 |
182.7 |
请参考上述数据填空和回答问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,用电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?
___________________________________________________________________________________________________________________________________。
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是___________________________________________________________________________________________________________________________________。
(15分,每小题各3分)下图中,A到L为常见物质或该物质的水溶液,B在A气体
中燃烧产生棕黄色烟,B、G为中学化学中常见金属单质,I的焰色反应为黄色,组成J的
元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色。
|
(6分)
在一个固定体积的密闭容器中,加入2 mol A和1 mol B,发生反应:2A(g)+B(g) 3C(g)+D(g)达到平衡时,C的浓度为W mol·L-1。若维持容器体积和温度不变,用下列物质作为起始反应物时,经反应达
3C(g)+D(g)达到平衡时,C的浓度为W mol·L-1。若维持容器体积和温度不变,用下列物质作为起始反应物时,经反应达 到平衡后C的浓度(用“大于”“小于”“等于”表示)。
到平衡后C的浓度(用“大于”“小于”“等于”表示)。
(1) 加入1 mol A和1 mol B时,C的平衡浓度______ W mol·L-1。
(2) 加入2mol A、1mol B、3mol C、1mol D时,C的平衡浓度______W mol·L-1
(3) 加入3 mol C和1 mol D时,C的平衡浓度_________ W mol·L-1。
(10分) 高炉炼铁过程中发生的主要反应为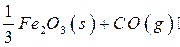

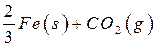
已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入F e、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率v(C02)= _____________、CO的平衡转化率= _____________:
e、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率v(C02)= _____________、CO的平衡转化率= _____________:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
| A.减少Fe的量 | B.增加Fe203的量 | C.移出部分C02 |
D.提高反应温度 E.减小容器的容积 F. 加入合适的催化剂 加入合适的催化剂 |
(6分)
某酸H2B在水溶液中有如下变化:H2B H++HB-;HB-
H++HB-;HB- H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
(1) 溶液中的H+物质的量取值范围是:
(2) 已知0.1mol·L-1NaHB溶 液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是0.11 mol·L-1(填“<”,“>”,或“=”),理由是:。
液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是0.11 mol·L-1(填“<”,“>”,或“=”),理由是:。
(6分)
(1)NaHCO3的水溶液呈(填“酸”、“中”、“碱”)性,实验室保存NaHCO3溶液的试剂瓶应用塞,原因
(写出有关的离子方程式,下同);Al2(SO4)3显酸性,溶液蒸干最后得到的固体产物是 ;
;
(2)普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是
。