利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下: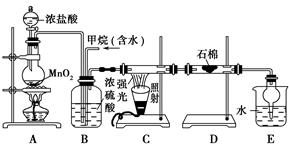
根据设计要求回答:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应________。
(3)D装置的石棉中均匀混有KI粉末,其作用是_____________________________________。
(4)E装置的作用是___________________(填编号)。
| A.收集气体 | B.吸收氯气 | C.防止倒吸 | D.吸收氯化氢 |
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式________________________________。
(6)E装置除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
为了达到下 表所列的实验目的,请选择合适的实验方法,将其标号填在答题上。
表所列的实验目的,请选择合适的实验方法,将其标号填在答题上。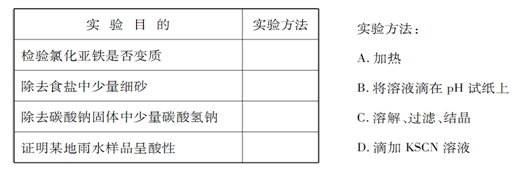
某研究性学习小组为测定,13.7g某Na2CO3样品的纯度(其中只含NaHCO3杂质),选用下图所示的仪器装置进行实验(②装置未画全)。试回答有关问题:
(1)请选择适当的仪器,连接装置的正确顺序是_。
(2)加热时NaHC03分解的化学方程式为。
(3)完成该实验尚缺的玻璃仪器是(填名称);产生气体从装置④的进入,从装置⑤的进入(填接口序号)。
实验二:测定上述实验完成后剩余固体与盐酸反应产生CO2的体积。
(4)加热后的固体与足量盐酸反应的离子方程式为。
数据分析及结论:
(5)加入盐酸至无气体产生时,生成CO2体积在标准状况时为2.24L,则Na2CO3样品的纯度为。
误差分析:
(6)有同学认为实验一⑤中用水会使测量结果产生误差,你认为原因可能是。
(7)有同学发现在实验—读取CO2体积时,⑥中液体的液面低于⑤中液体的液面,但未做任何处理,则a值(填“偏大”、“偏小”或“无影响”)。
某些化学反应可表示为:A+B=C+D十H2O(未配平,条件略)。请回答:
(1)若A为主族元素,A与B的浓溶液在常温时发生钝化,但A与B的稀溶液反应产生无色气体并能迅速转化为红棕色。请写出A与B的稀溶液反应的化学方程。
(2)若A、D均可用于消毒,且C是家家户户的厨房必备的物质之一,写出该反应的离子方程式。
(3)若A为黑色固体,C是黄绿色的单质气体。当产生标准状况下33.6LC气体时,参加反应的A的质量为。
(4)已知炭和浓硫酸在加热时也符合上述反应式,某同学设计如下实验证明其产物。则: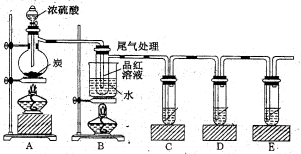
若证明有水生成,需要在.A、B之间加装盛有的干燥管。若证明生成CO2,需要C试管盛放(填化学式)溶液。装置B可以探究SO2与品红作用的可逆性,请写出实验操作及现象;该实验的尾气可采用NaOH溶液吸收,有关反应离子方程式为。
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
用如图所示装置进行Mg和SO2反应的实验。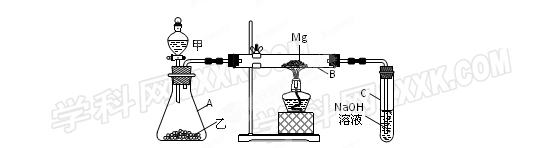 (1)选择制取SO2的最合适试剂(填序号)。
(1)选择制取SO2的最合适试剂(填序号)。
①10%的H2SO4溶液②80%的H2SO4溶液
③Na2SO3固体④CaSO3固体
(2)写出装置乙和B中发生的主要反应的化学方程式:
乙中;
B中。
装置C中NaOH溶液的作用是。
(3)你认为该装置是否有不足之处?。如果有,请说明。
某化学研究性学习小组拟测定食醋的总酸量(g/10mL),请你参与该小组的实验并回答相关问题。
[实验目的]测定食醋的总酸量
[实验原理]中和滴定
[实验用品]蒸馏水,市售食用白醋样品500mL(商标注明总酸量:3.50g/100mL~5.00g/100mL),0.1000mol/L NaOH标准溶液;100mL容量瓶,10mL移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊)。
[实验步骤]
①配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中。
②盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
③滴定
往盛有待测食醋溶液的锥形瓶中的滴加某酸碱指示计2~3滴,滴定至终点。记录NaOH的终读数。重复滴定3次。
[数据记录]
[问题与思考]
(1)步骤①中用煮沸并迅速冷却的方法处理蒸馏水的目的是除去,防止其对实验结果的影响。
(2)步骤③中你选择的酸碱指示剂是,理由是。
(3)样品总酸量=g/100mL。
(4)导致实验结果偏大的主要原因是(填写序号)
①滴定终点时,仰视滴定管读数
②滴定后滴定管尖嘴处悬有一滴液体
③移液管用蒸馏水洗净后,就用来吸取待测液
④滴定前,碱式滴定管无气泡,滴定后产生气泡
⑤锥形瓶只用蒸馏水洗涤后仍留有少量蒸馏水