口服抗菌药利君沙的制备原料G和某种广泛应用于电子电器等领域的高分子化合物I的合成路线如下: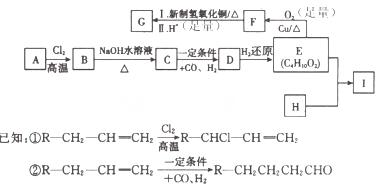
(1)A的结构简式是______,A→B的反应类型是________,D中官能团的名称__________。
(2)写出E→F的反应方程式_______________。
(3)H的分子式为C8H6O4,能与碳酸钠溶液反应放出气体,其一氯代物只有一种,写出E+H→I的反应方程式__________________________________________________。
(4)H的同分异构体有多种,写出其中能满足①能发生银镜反应,②能与碳酸氢钠溶液反应,③核磁共振氢谱有四种峰三个条件的芳香类同分异构体的结构简式__________________。
(5)关于G的说法中正确的是_____________(填序号)
a.1molG可与2molNaHCO3溶液反应
b.G可发生消去反应
c.lmolG可与2mol H2发生加成反应
d.G在一定条件下可与Cl2发生取代反应
已知N2(g)+3H2(g)⇌2NH3(g);△H=﹣Q1 kJ·mol-1(Q1>0),在一个有催化剂的固定容积的容器中加入1molN2和3molH2,在500℃时充分反应,达平衡后NH3的浓度为w mol•L﹣1,放出热量为Q2 kJ.
(1)达到平衡时,N2的转化率为 ;若此时向原容器中通入少量的氩气,N2的转化率将 (填“增大”、“减小”或“不变”)
(2)若在原来的容器中,只加入2mol NH3,500℃时充分反应达平衡后,吸收热量Q3 kJ,则NH3浓度 (填>、=、<)w mol•L﹣1,Q1、Q2、Q3之间满足何种关系 。
(3)下列措施可以同时提高反应速率和H2的转化率是(填选项序号) .
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3d.升高温度
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入1molN2和3 molH2,500℃时充分反应达平衡后,放出热量Q4kJ,则Q2 Q4(填“>”、“<”或“=”).
已知25℃时有关弱电解质的电离平衡常数如下表:
| 弱电解质化学式 |
CH3COOH |
HCN |
H2CO3 |
NH3.H2O |
| 电离平衡常数 |
1.8×l0–5 |
4.9×l0–10 |
K1=4.3×l0–7 K2=5.6×l0–11 |
1.8×l0–5 |
根据上表中数据回答下列问题:
(1)CH3COO-、CN-、CO32-结合质子(即H+)的能力大小顺序__________________;25℃时,有等浓度的①CH3COONa溶液、②NaCN溶液、③NaHCO3溶液,三种溶液的pH由大到小的顺序为 (填序号)。
(2)NaCN溶液中通入少量二氧化碳,反应的离子方程式为
(3)向稀氨水中加入等体积等浓度的醋酸溶液,则反应后溶液中各离子浓度大小关系为
(4)甲、乙两瓶氨水的浓度分别为1mol·L-1、0.1mol·L-1,则c(OH-)甲﹕c(OH-)乙 10(填“>”、“=”或“<”)。
(1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6 kJ热量,写出表示CH4的燃烧热的热化学方程式 。
(2)等物质的量浓度的下列溶液:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH4Fe(SO4)2中 ,c(NH4+)由大到小的顺序为 。
(3)写出符合要求的方程式
①饱和的FeCl3溶液滴入沸水中 (写离子方程式)
②NaHCO3在水溶液中存在的所有电离过程
(4)某温度下的溶液中,c(H+)=10xmol•L-1,c(OH-)=10ymol•L-1。x与y的关系如图所示: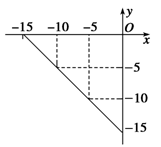
①该温度下,NaCl溶液的pH= 。
②该温度下,pH=8的Ba(OH)2溶液与pH=6的盐酸混合,并保持恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。(忽略溶液混合时体积变化)
在200mL 2mol•L﹣1MgCl2溶液中,溶质的物质的量为 .此溶液中Mg2+的物质的量浓度为 ,Cl﹣的物质的量浓度为 .
某同学按下列步骤配制500mL 0.200mol/L KCl 溶液:
①将烧杯中的溶液转移至500mL 容量瓶中 ②称量KCl 固体 ③向容量瓶中加蒸馏水至刻度线 ④计算所需KCl的质量 ⑤将KCl加入100mL 烧杯中,并加适量水
(1)④计算所需要KCl 的质量为 ;
(2)实验的先后顺序应为 (填写序号);
(3)在 ①实验中,为防止溶液溅出,应采取的措施是 ;
(4)在进行 ③的实验操作时应注意的问题是 ;
(5)在进行 ⑤时,为了加快溶解速率,可以采取的措施是 .
(6)配制溶液时,下列实验操作会使配制溶液浓度偏高的是
| A.容量瓶内有水,未经过干燥处理 |
| B.定容时,俯视刻度线 |
| C.移液完成后,溶解KCl的烧杯未用蒸馏水洗涤 |
| D.定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线 |