2014年全运会在辽宁举办,其开幕式就是一场焰火盛宴。
(1)焰火利用了部分金属元素特征的 反应,该反应属于 (填“物理”或“化学”)变化。
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,每种化合物仅含两种元素。
图中A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E分子结构的球棍模型为 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为 ,D的化学式是 。
②A、B、E中均含有的一种元素符号为 。
③C与纯碱反应的化学方程式为 。
④液态B与液态E反应可生成一种单质和一种常见液体,1 mol B参加反应放出热量Q kJ,其反应的热化学方程式为 。
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
则X、Y、Z的电负性从大到小的顺序为___________ (用元素符号表示),元素Y的第一电离能大于X的第一电离能原因是__________________________________。
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化。
①A、B、C的第一电离能由小到大的顺序为_________________ (用元素符号表示)。
②M是含有______共价键的(填“极性”或“非极性” )
③W分子的VSEPR模型的空间构型为_________,W分子的空间构型为__________。
④AB-离子中和B2分子的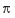 键数目比为_______________。
键数目比为_______________。
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1。
①F元素在其化合物中最高化合价为_____。
②G2+离子的核外电子排布式为__________。
a、b、c、d、e、f、g、h为8种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 |
a |
b |
c |
d |
e |
f |
g |
h |
| 原子核个数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
多核 |
| 带电荷数(单位:电荷) |
0 |
+1 |
-1 |
0 |
+2 |
+1 |
0 |
+1 |
其中b的离子半径大于e的离子半径,d是由极性键构成的四原子分子;c与f可形成两个共价型g分子,d微粒和h微粒在一定条件下可互相转化,试写出:
(1)a微粒原子核外结构示意图:___________,该元素属于周期表中的_____区。
c微粒电子式为 ___________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:
________>___________(写化学式)
(3)c微粒和f微粒反应生成2分子g的离子方程式为_____________________。
(4)大量c微粒和大量h微粒共热生成d微粒的离子反应方程式为______________。
(5)微粒g中心原子杂化方式为_______;d微粒分子结构呈__________型;
按要求回答下列问题:
(1)画出第三周期核外未成对电子最多的基态原子的价电子排布图______________;
(2)写出族序数为周期数三倍的主族元素的原子电子排布式_____________________;
(3)用价层电子对互斥模型推测下列分子或离子的空间构型及中心原子的杂化方式。
SCl2 _________、__________;BeCl2_________、_________;
(4)写出所给微粒的一种等电子体的化学式:SO2 : SO42-___________.
“碘钟”实验中,3I-+S2O82-===I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃下进行实验,得到 的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
| c(S2O82-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是_____________________________________________________________。
(2)显色时间t1=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为________(填字母)。
A.<22.0 s B.22.0~44.0 s
C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是____________________________________
________________________________________________________________________。
在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_________________________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol•L-1•s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。