Ba2+是一种重金属离子,有一环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的物质的量浓度。
(1)在容量瓶的使用方法中,下列操作不正确的是(填字母)________。
| A.使用容量瓶前检查它是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液润洗 |
| C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近标线1~2 cm处,用滴管逐滴滴加蒸馏水至标线 |
| D.配制溶液时,若试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加水至接近标线1~2 cm处,用滴管逐滴滴加蒸馏水至标线 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(2)现需配制250 mL 0.100 mol·L-1的标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250 mL容量瓶、玻璃棒外,还需要________________。
(3)需准确称取Na2S2O3固体的质量为________g。
(4)另取废水50.00 mL,控制适当的酸度,加入足量的K2Cr2O7溶液,得到BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加入过量KI溶液进行反应,然后在反应液中滴加上述标准Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00 mL。已知有关反应的离子方程式为①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;②I2+2S2O32-=2I-+S4O62-。则该工厂废水中Ba2+的物质的量浓度为________。
某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:
实验一、把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验二、把纯锌片投入到含FeCl3的同浓度工业盐酸中,发现放出氢气量减少。
实验三、将不纯的锌片与盐酸反应,发现反应速率加快。
实验四、在盐酸中滴入几滴CuCl2溶液,同样生成氢气速率加快。
问题:
(1)试分析实验一中t1~t2速率变化的主要原因是,t2~t3速率变化的主要原因是。
(2)实验二放出氢气量减少的原因是。
(3)某同学认为实验四反应速率加快原因,均为原电池的存在,你认为是否正确,若不正确,说明原因。若正确写出原电池的正、负极及电解质溶液。
(7分)一定温度下,在容积为V L的密闭容器中进行反应:aN(g)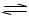 bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中a :b=__________;
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:_________________________;
(3)下列叙述中能说明上述反应达到平衡状态的是_______________。
| A.反应中M与N的物质的量之比为1︰1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内每消耗a mol N,同时生成b mol M |
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
如图所示装置:
(1)若烧杯中溶液为稀硫酸,两极反应式为:
正极;负极。
(2)若烧杯中为氢氧化钠溶液,两极反应式为:
正极;负极。
(3)若烧杯中为氯化钠溶液,两极反应式为:正极;负极。
(8分)某简单微粒的结构示意图为:
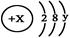 且X、Y 均为不大于20的正整数,据此回答下列问题:
且X、Y 均为不大于20的正整数,据此回答下列问题:
(1)若该微粒一般情况下不与其它元素的原子反应,这种微粒的符号是;
(2)若该微粒有很强的非金属性,且只需得到一个电子就能达到稳定结构,这种微粒的结构示意图为。
(3)若该微粒为一价阳离子,且对应的碱为可溶性强碱,则x= ,y=。
(11分)已知A、B、C、D、E是短周期中的五种非金属元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色固体,易溶于二硫化碳。
(1)请写出元素符号: B___________、D___________。
(2)画出E的阴离子的结构示意图 ______________________。
(3)A的单质和C的单质在一定条件下反应生成化合物X,用电子式表示化合物X的形成过程:____________________________ _______。向X的水溶液中滴入酚酞溶液,会观察到什么现象:_________________________。