铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:
__________________________________________________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为____________________。与MnO2Zn电池类似,K2FeO4Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_____________________,该电池总反应的离于方程式为__________________________。
右图是周期表的一部分,A、B、C、D、E 5种元素的原子核外共含有80个电子。
(1)A、B、C、D的元素符号分别是:
A ,B,C,
D,
(2)A、B、C的的酸性由强到弱的顺序是(用化学式表示)
。
(3)A的最高价氧化物对应的水化物体现(填“酸性 ”、“碱性”、“两性”),用离子方程式表示为:、
。
(4)E为(填“金属”、“非金属”),其单质可能为 (填“导体”、“非导体”、“半导体”),推断理由是
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时得到一种白烟Y和一 种强酸Z,丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。请回答下列问题
(1)戊离子的结构示意图为_______。
(2)写出乙和Y的电子式:_______、___________。
用电子式表示Z的形成过程________________________________
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为________。
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:
有1H、D、T三种原子:
(1) 在同温同压下,它们的单质的密度之比是;
(2) 1mol各种单质中,它们的质子数之比是;
(3) 1g各种单质中它们的中子数之比是;
(4) 在标准状况下,1L各种单质中,它们的电子数之比是。
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。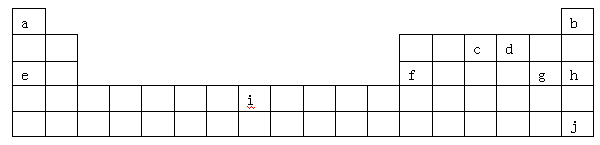
(1)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图__________。
(2)由以上元素形成的金属单质中,熔点最低的是__ __。(填元素符号)
(3)NH3·H2O的电离方程式为NH3·H2O NH4++OH-,试判断NH3溶于水后,右图中形成的NH3·H2O的合理结构是________(填序号)。
NH4++OH-,试判断NH3溶于水后,右图中形成的NH3·H2O的合理结构是________(填序号)。
(4)a位于第ⅠA族,有人认为a也可以放在ⅦA族,下列物质能支持这种观点的是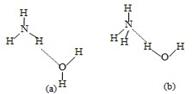
| A.HF | B.H3O+ | C.NaH | D.H2O2 |
(5)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是_________(填写字母)。
(6)利用稀有气体化合物,人们实现了许多制备实验上的突破。如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe。写出该反应的方程式:
W、M、X、Y、Z、Q是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。六种元素核电荷数之和为71,W、Q最外层电子数相同,Q的核电荷数是W的2倍。Z的单质和氧化物均为原子晶体。工业上一般通过电解氧化物的方法获得Y的单质。请回答下列问题:
(1)Y的离子结构示意图____________;M元素在元素周期表中的位置为______________。
(2)写出电子式并在括号内指出所含化学键的类型:W的单质______________();
X与W按原子个数比2:1形成的化合物_____________()。
(3)W、M、X、Y、Z、Q原子半径由小到大的顺序为__________________(用元素符号表示)。
(4)W、M、Q形成的氢化物的稳定性_______________________(用氢化物分子式表示);Z元素氢化物的分子空间构型___________________。
(5)X、Y、Q的最高价氧化物对应的水化物之间两两均可反应,写出反应的离子方程式:
________________________,________________________,______________;