最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下: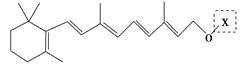
为了研究X的结构,将化合物A在一定条件下水解只得到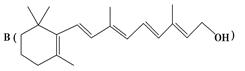
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。
(ⅰ)写出有机物的结构简式:D:______________,
C:________________,E:__________________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;
反应⑥__________________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时得到一种白烟Y和一 种强酸Z,丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。请回答下列问题
(1)戊离子的结构示意图为_______。
(2)写出乙和Y的电子式:_______、___________。
用电子式表示Z的形成过程________________________________
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为________。
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:
有1H、D、T三种原子:
(1) 在同温同压下,它们的单质的密度之比是;
(2) 1mol各种单质中,它们的质子数之比是;
(3) 1g各种单质中它们的中子数之比是;
(4) 在标准状况下,1L各种单质中,它们的电子数之比是。
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。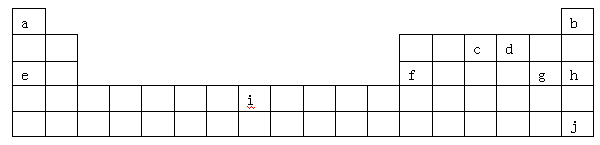
(1)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图__________。
(2)由以上元素形成的金属单质中,熔点最低的是__ __。(填元素符号)
(3)NH3·H2O的电离方程式为NH3·H2O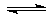 NH4++OH-,试判断NH3溶于水后,右图中形成的NH3·H2O的合理结构是________(填序号)。
NH4++OH-,试判断NH3溶于水后,右图中形成的NH3·H2O的合理结构是________(填序号)。
(4)a位于第ⅠA族,有人认为a也可以放在ⅦA族,下列物质能支持这种观点的是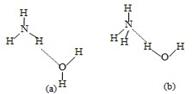
| A.HF | B.H3O+ | C.NaH | D.H2O2 |
(5)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是_________(填写字母)。
(6)利用稀有气体化合物,人们实现了许多制备实验上的突破。如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe。写出该反应的方程式:
W、M、X、Y、Z、Q是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。六种元素核电荷数之和为71,W、Q最外层电子数相同,Q的核电荷数是W的2倍。Z的单质和氧化物均为原子晶体。工业上一般通过电解氧化物的方法获得Y的单质。请回答下列问题:
(1)Y的离子结构示意图____________;M元素在元素周期表中的位置为______________。
(2)写出电子式并在括号内指出所含化学键的类型:W的单质______________();
X与W按原子个数比2:1形成的化合物_____________()。
(3)W、M、X、Y、Z、Q原子半径由小到大的顺序为__________________(用元素符号表示)。
(4)W、M、Q形成的氢化物的稳定性_______________________(用氢化物分子式表示);Z元素氢化物的分子空间构型___________________。
(5)X、Y、Q的最高价氧化物对应的水化物之间两两均可反应,写出反应的离子方程式:
________________________,________________________,______________;
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,B与C的单质在加热条件下反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)写元素符号:A为 ,B为 。
(2)写出元素C在周期表中的位置 。
(3)D的最高价氧化物的水化物化学式是。
(4)E属(“离子”或“共价”)化合物。E中含键。
(5)写出A、B形成的化合物与E反应的化学方程式:
。
(6)C与D两元素可形成化合物,用电子式表示其化合物的形成过程
。