化合物B是有机合成中间体,制取C4H4O4和E的转化关系如下图所示。已知C能使溴水褪色。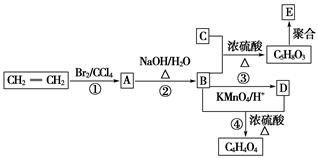
回答下列问题:
(1)指出反应类型:①________;②________。
(2)E的结构简式为:_____________________________________。
(3)写出②、④转化的化学方程式:
②__________________________________________________________;
④___________________________________________________。
下图所示为实验制取纯净干燥的Cl2,并进行检验Cl2性质的实验装置。其中E瓶中放有干燥红色布条,F中为铜网,F右端出气管口附有脱脂棉。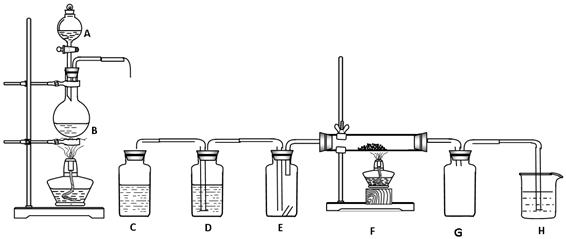
(1)洗气瓶C、D中分别盛有的试剂是 、 。
(2)E中现象是 ,
(3)F中反应的化学方程式为 。
(4)B中反应的离子方程式为 。
(5)整套装置中有两处酒精灯加热,实验时应先点燃 处的酒精灯。
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1) A、B、C、D中所有原子都在同一平面上的是________________________。
(2)写出下列反应的反应类型:①____________,④______________。
(3)写出下列反应的化学方程式:
①______________________________________________________;
②_______________________________________________________;
④________________________________________________________。
有A、B、C、D、E5种元素,已知:
①A原子最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子第三层上的电子比第一层多5个。
②常温下B2是气体,相同条件下,它的密度是氢气的16倍。
③C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
④D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2。D在DB2中的含量为50%。根据以上情况回答:
(1)D是,其在周期表中的位置为。
(2)E的原子结构示意图为,C的离子结构示意图为。
(3)F和AB2反应的化学方程式为。
(4)F中含有的化学键为。
有机物A可发生如下转化:
(1)化合物A是一种邻位二取代苯,其中一个取代基是羧基,则A的结构简式是_____。
(2)反应①②都可属于取代反应。其中①是__________反应,②是________反应
(3)反应③的化学方程式是 _______________________________。
(4)A与NaOH溶液共热,可发生反应生成B与C的钠盐。与1mol A反应所消耗的NaOH物质的量为_________mol。
(5)与A具有相同官能团(—COOH和—COO—)的A的同分异构体很多,请写出其中三种邻位二取代苯的结构简式____________、________________、_________________。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42—、OH- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。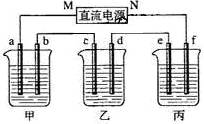

接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的极(填写“正”或“负”)电极b上发生的电极反应为;
(2)计算电极e上生成的气体在标准状态下的体积:;
(3)写出乙烧杯的电解池反应
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是。