欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:
方法二: 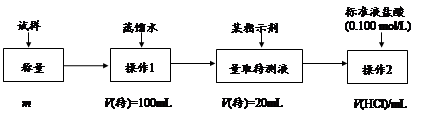
方法三: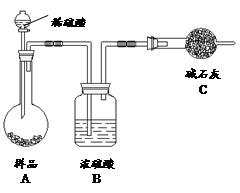
方法四:不使用化学试剂,使用实验室常用仪器
按要求回答下列问题:
(1)方法一:加入足量的试剂A (填写A的化学式)可将HCO3-离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、 、洗涤和 ;
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要的用到的是 ,在操作2中应选择的指示剂是 ;
(3)在方法二中计算该样品中NaHCO3的质量分数为 [用流程图中的数据m、V(HCl) 填写有关的表达式];
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是 ;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是 ,偏低的原因可能是 (均文字简述);
(6)方法四的实验原理是: (用化学方程式表示)。
推断题科学家们在探索生命奥妙过程中,认识到生命细胞的组成和元素周期律有密切的关系,约占人体质量99.97%的11种大量元素全部位于周期表前20号元素,其余的是十多种人体不可缺少的微量元素。现有a~g 7种短周期元素,是氧、硫、钾、钙外的其它大量元素,它们在元素周期表中的位置如下,并据此回答下列问题:
| a |
|||||||
| d |
e |
||||||
| b |
c |
f |
g |
(1)元素的原子间最容易形成离子键的是下列中的(填选项),元素的原子间最容易形成共价键的是下列中的(填选项)。
A、c和f B、b和g C、d和gD、b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是(填选项)
A、ea3 B、ag C、fg3 D、dg4
某酸是一种常见的有机酸,其结构为:
(1)此有机酸含有的官能团名称是____________;在一定条件下,此有机酸可发生化学反应的类型有 ________(填序号);
| A.水解反应 |
| B.取代反应 |
| C.加成反应 |
| D.消去反应 |
E.加聚反应
F.中和反应
(2)下列物质与此酸互为同分异构体的是_____________(填序号);




(3)写出此有机酸与足量的金属钠发生反应的化学方程式:__________________________;
下表是有机物A、B的有关信息。
| A |
B |
| ①能使溴的四氯化碳溶液退色 ②比例模型为:  ③能与水在一定条件下反应生成醇 |
①由C、H两种元素组成 ②球棍模型为:  |
根据表中信息回答下列问题:
(1)A的名称为___________,A在一定条件下生成高分子化合物的反应方程式________________。
(2)A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=时,这类有机物开始出现同分异构体。
(3)B具有的性质是(填序号)。
①无色无味液体、②有毒、③不溶于水、④密度比水大、
⑤与酸性KMnO4溶液和溴水反应使之退色、⑥任何条件下不与氢气反应。
(4)写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:_____________________________。
完成下列有机化合物之间的转换
(1)CH3CH=CH2 + () CH3CHClCH2Cl
CH3CHClCH2Cl
(2) ()
()
(3)CH3CH2-Br CH2=CH2
CH2=CH2
(4)()+ Br2 CH3-CBr=CHBr
CH3-CBr=CHBr
(5)
 ()(一卤代物)
()(一卤代物)
焦硫酸(H2SO4•SO3)溶于水,其中SO3都转化为硫酸。若将445 g焦硫酸溶于水配成4.00 L硫酸,该硫酸的物质的量浓度为_______________mol/L。