阿司匹林(乙酰水杨酸,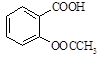 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
主要试剂和产品的物理常数
请根据以上信息回答下列问题:
(1)①合成阿斯匹林时,最合适的加热方式是 。
②抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是 。
(2)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤,则加饱和NaHCO3溶液的目的是 。
另一种改进的提纯方法,称为重结晶提纯法。方法如下: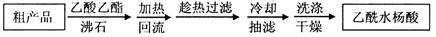
(3)改进的提纯方法中加热回流的装置如图所示,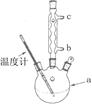
①使用温度计的目的是 。冷凝水的流进方向是 。(填“b”或“c”)。
②重结晶提纯法所得产品的有机杂质要比原方案少的原因 。
(4)检验产品中是否含有水杨酸的化学方法是 。
(5)该学习小组在实验中原料用量:2.0 g水杨酸、5.0 mL醋酸酐(ρ=1.08 g/cm3),最终称得产品m=2.2 g,则所得乙酰水杨酸的产率为 。
(9分)O3氧化海水中的I-是大气中碘的主要来源,将O3通入稀硫酸酸化的NaI溶液中进行模拟研究。
(1)为探究外界条件对I2生成速率的影响,做了如下三组实验,填写表中的空白处。
| 编号 |
实验目的 |
反应物 |
反应前溶液的pH |
温度 |
| 1 |
对照组 |
O3+NaI+H2SO4 |
5.2 |
25℃ |
| 2 |
①__________ |
O3+NaI+H2SO4+FeCl2 |
5.2 |
②_____ |
| 3 |
探究温度对反应速率的影响 |
O3+NaI+H2SO4 |
③_______ |
5℃ |
(2)为测定生成I2的量,用移液管取20.00mL反应后溶液于锥形瓶中,用 c mol·L-1的Na2S2O3标准液滴定,消耗V mLNa2S2O3溶液。
已知:①H2S2O3是一种弱酸;②2Na2S2O3+ I2= Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶外,还需要的玻璃仪器是_____________;
②该实验中可选用_______(填物质名称)作指示剂。
③反应后溶液中碘的含量为_________ g·L-1。
④甲同学认为在滴定前应微热溶液,以排除溶液中溶解的O3和O2,不然会使滴定结果偏_____(填“低”或“高”)。
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图。
(1)下列关于图像的说法不正确的是(填序号,下同);
①a → b段产生H2加快可能是表面的氧化膜逐渐溶解,加快了反应速率
②b → c段产生H2较快可能是该反应放热,导致温度升高,加快了反应
③c以后,产生H2速率逐渐下降可能是铝片趋于消耗完全
(2)其他条件不变,现换用500 mL 1 mol·L-1盐酸,产生氢气速率普遍较使用500 mL 0.5 mol·L-1硫酸的快,可能的原因是________;
①盐酸中c(H+)的浓度更大
②Cl-有催化作用
③SO42-有催化作用
④SO42-有阻化作用(使反应变慢)
⑤Al3+有催化作用
(3)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②加入蒸馏水;③将铝片换成铝粉;④增加硫酸的浓度至18 mol/L;⑤;⑥ _。以上方案不合理的有;请你再补充两种合理方案,填入空白⑤⑥处。
(1)实验室用下图所示装置制备少量乙酸乙酯。
①写出制备乙酸乙酯的化学方程式_______________________。
②试管Ⅱ中盛的试剂是____________________________。
③若要把制得的乙酸乙酯分离出来,应采用的实验操作是________。
(2)已知乳酸的结构简式为 。试回答:
。试回答:
①乳酸分子中含有________和_________两种官能团(写名称);
②乳酸与足量金属钠反应的化学方程式为_____________________________;
如图是硫酸试剂瓶标签上的部分内容。现实验室需要240ml 4.6mol/L的稀硫酸用该硫酸配置,
则:(1)需要该浓硫酸的体积为mL;
(2)可供选用的仪器有:胶头滴管;烧瓶;烧杯;药匙;量筒;托盘天平.配置稀硫酸时,还缺少的仪器有______、______。
(3)配置过程中有几个关键的步骤和操作如图所示:将下列实验步骤A-F按实验过程先后次序排列_______________。
(4)该同学实际配置得到的浓度为4.5mol/L,可能的原因是。
| A.量取浓H2SO4时俯视刻度 |
| B.容量瓶洗净后未经干燥处理 |
| C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作 |
| D.定容时仰视刻度线 |
已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气。请用下图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系。
实验测得数据和有关结果如下:
①准确称得无水硫酸铜 2.4 g;
②测出量筒中水的体积,折算成标准状态下气体的体积为112 mL;
③干燥管在实验后质量增加1.28 g;
④实验结束时装置B中的NaHSO3溶液变为Na2SO4溶液(不含其他溶质)。
请回答下列问题:
(1)装置B的作用是;发生的化学方程式________________________。
(2)装置C的作用是__________________;干燥管收集到的物质是__________。
(3)实验数据测出后,计算出氧气的物质的量有________mol;并据此计算出SO2为_________mol,SO3为___________mol。