电化学原理在工业生产中有着重要的作用,请利用所学知识回答有关问题。
(1)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。如是电解产生多硫化物的实验装置: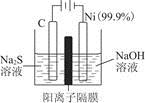
①已知阳极的反应为(x+1)S2-=Sx+S2-+2xe-,则阴极的电极反应式是____________________________
当反应转移x mol电子时,产生的气体体积为____________(标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示):___________________________。
(2)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为______________________。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为_______________________,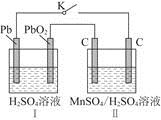
当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为________,MnO2的理论产量为________g。
(3)用图电解装置可制得具有净水作用的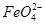 。实验过程中,两极均有气体产生,Y极区溶液逐渐生成
。实验过程中,两极均有气体产生,Y极区溶液逐渐生成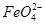
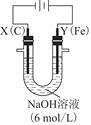
①电解过程中,X极区溶液的pH________(填“增大”“减小”或“不变”)。
②电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=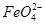 +4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
+4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
(8分) 将一定质量的Al、Fe混合物加入到足量的盐酸中,充分反应后得到标准状况下的氢气8.96L;如果将等质量的该混合物加入到足量的NaOH溶液中,充分反应后得到标准状况下的氢气6.72L。
(1)写出与碱反应涉及的化学方程式:_____________________________________
(2)混合物中Al和Fe的质量分别为________和__________
(3)当混合物与盐酸反应时,转移电子数为_______mol;与NaOH溶液反应时转移电子
数为_______mol。
A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3—、SO42—、Cl—、SO32—的某一种。
①若把四种盐分别溶解于盛有蒸馏水的四只试管中,只有C盐的溶液呈蓝色。
②若向①的四只试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有刺激性气体逸出。根据实验事实可推断它们的化学式为:
A_________、B_________、C_________、D____________
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示。
请回答:
(1)写出B物质的化学式:;F的名称:。
(2)写出第③步反应的化学方程式为。
(3)第④步反应中溶液颜色的变化;
写出第④步反应的离子方程式。
(4)写出SO2和B反应的离子方程式。
(5)F溶液中滴入NaOH溶液可能产生的实验现象是。
(共 11 分)
(1)有一种叫做钾长石(K2Al2Si6O16),其化学式为写成氧化物的形式为______________
(2)反应3Cu+8HNO3 = 3Cu(NO3)2+2NO↑+4H2O 的离子方程式为:
每生成11.2L标准状况下的气体,被还原的(填名称)的质量为 g。
得电子与失电子个数比是_____,被氧化与被还原的原子的个数比为______,试用“单线桥”标出该反应电子转移方向和数目:_____________________________ (3)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应
(3)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应
① A + H2O → B + C② C + F → D③ D + NaOH → F + E + H2O
写出A 、B、 C的化学式A______ B ____ C______
写出反应③的离子方程式
(4分) A为烃,B为烃的含氧衍生物,取等物质的量的A和B混合物共0.5mol在1.5mol的氧气中完全燃烧,生成1molCO2和1.5molH2O。另取一定量的A和B完全燃烧,将其以任意物质的量比混合,且物质的量之和一定试通过计算回答:
(1)若生成CO2和水的物质的量一定,则A和B的分子式分别是(任写一组)
(2)若耗氧量一定,则A和B的分子式分别是(任写一组)