以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) ∆H = —49.0 kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ∆H = —173.6 kJ·mol-1
CH3CH2OH(g)+3H2O(g) ∆H = —173.6 kJ·mol-1
(1)写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:
(2)对反应Ⅰ,在一定温度下反应达到平衡的标志是 (选填编号)
a.反应物不再转化为生成物 b.平衡常数K不再增大
c.CO2的转化率不再增大 d.混合气体的平均相对分子质量不再改变
(3)在密闭容器中,反应Ⅰ在一定条件达到平衡后,其它条件恒定,能提高CO2转化率的措施是 (选填编号)
| A.降低温度 | B.补充CO2 | C.加入催化剂 | D.移去甲醇 |
(4)研究员以生产乙醇为研究对象,在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。表示CH3CH2OH组分的曲线是 ;图中曲线Ⅱ和Ⅲ的交点a对应的体积分数ya= %(计算结果保留三位有效数字)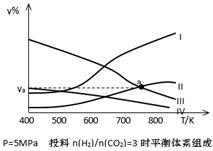
(5)一种以甲醇作燃料的电池示意图如图。写出该电池放电时负极的电极反应式: 。
(1)研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是(填序号)
| A.铁片置于硫酸铜溶液中有铜析出; |
| B.铁、铜与氯气反应分别生成FeCl3、CuCl2; |
| C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu="2" FeCl2+ CuCl2) |
| D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡 |
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
(2)请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
a.此方案的原理不同于上述任一合理方案;b.绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象。
| 实验装置 |
实验现象 |
实验结论 |
某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,回答下列问题: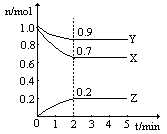
(1)图中X曲线代表(填化学式);
(2)从开始至2min,NH3的平均反应速率是;
(3)第4分钟时下列叙述正确的是;
| A.该反应已停止 |
| B.单位时间内氮气的消耗速率等于氢气的生成速率 |
| C.3v(H2)=2v(NH3) |
| D.c(H2) :c(N2) :c(NH3) =" 7" :9 :2 |
(4)若拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则1 mol N2与3mol H2反应完全转化为NH3应_________热量(填“吸收”或“放出”)kJ。
欲探究氯气与碘单质的氧化性强弱,某同学设计了如下装置(用浓盐酸和KMnO4固体反应制取氯气)。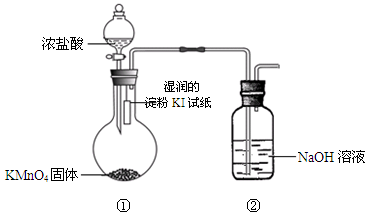
请回答:
(1)实验中观察到湿润的淀粉KI试纸,写出其中发生的置换反应的离子方程式: 。
(2)实验结论:氯单质的非金属性比碘单质的(填“强”或“弱”)。从原子结构角度解释:氯和碘位于周期表中族,该族元素从上到下,,得电子能力减弱。
(3)装置②的作用是。
写出相应的化学方程式:
能源是现代社会发展的三大支柱之一。化学在提高能源的利用率和开发新能源中起到了重要的作用。
(1)下列说法中,正确的是。(填序号)
| A.煤、石油和天然气都是可再生的能源 |
| B.目前使用的手机电池为二次电池,放电时是将化学能转化为电能 |
| C.人体运动所消耗的能量与化学反应无关 |
| D.人类目前所直接利用的能量大部分是由化学反应产生的 |
(2)电能是现代社会中应用最广泛的二次能源,下列装置中能够实现化学能转化为电能的是(填序号)。写出该装置正极反应的电极反应式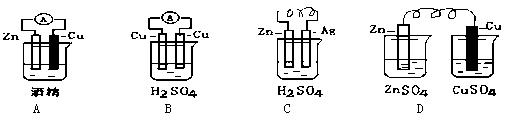
(3)锌锰干电池是目前使用最广泛的一种电池,其正极材料是石墨棒,它在放电时总反应式可表示为:Zn+ 2 MnO2 + 2 NH4+ ="=" Zn2+ + Mn2O3(S)+ 2NH3 + H2O。写出该电池负极反应的电极反应式。当电极锌消耗6.5g时,可对外提供的电子是mol。
(4)右图是氢氧燃料电池构造示意图(电解质溶液为稀硫酸)。关于该电池的说法不正确的是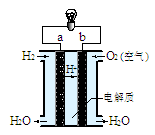
①.a极是负极
②.正极的电极反应是:O2+2H2O+4e-=4OH-
③.该装置可以将化学能完全转化为电能
④.氢氧燃料电池是环保电池
(5)人类在使用能源的过程中会产生环境问题。利用化学反应可以有效的进行治理。减少汽车等机动车尾气污染可在汽车尾气系统中增加催化转化装置,尾气中的CO、NO在催化剂的作用下反应生成两种参与大气循环的无毒气体,写出该反应的化学方程式。
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
 (1)9种元素中,原子半径最小的是。
(1)9种元素中,原子半径最小的是。
(2)④、⑤、⑥三种元素形成的简单离子中,离子半径最大的是。
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是__________________。
(4)元素③的氢化物的电子式为;该氢化物常温下和⑨的氢化物两者反应的实验现象是,上述反应得到一种盐,属于化合物(填离子或共价)。检验该盐溶液中阳离子存在的方法是
(5)⑤和⑧两元素可形成化合物,该化合物灼烧时火焰颜色为色,用电子式表示该化合物的形成过程。
(6)写出⑥的最高价氧化物与⑤的最高价氧化物对应水化物反应的离子方程式。 (7)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为____________(填序号)。
(7)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为____________(填序号)。 A.MnO2 B.FeCl3 C.Na2SO3 D.KMnO4
A.MnO2 B.FeCl3 C.Na2SO3 D.KMnO4