 A物质为重要的有机化合物,可以发生如下所示的一系列反应。
A物质为重要的有机化合物,可以发生如下所示的一系列反应。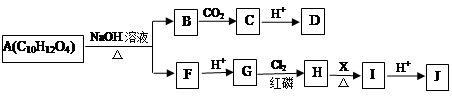
已知:①A分子中苯环上有两个对位的取代基;可以与碳酸氢钠反应生成二氧化碳。
②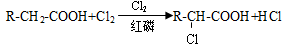
③F的分子式为C3H5O2Na。
请回答下列问题:
(1)可选用__________(填试剂名称)检验C物质中的官能团;D的结构简式为________。
(2)I分子结构中含有碳碳双键,则试剂X为________。
(3)J可以发生的反应类型有__________(填序号)
a.消去反应 b.酯化反应 c.加聚反应 d.缩聚反应
(4)A与足量NaOH水溶液反应的化学方程式为_______________________。
(5)K满足以下条件,则K的结构简式为_______________。
①与A物质为同系物,且比A分子少一个C原子;
②苯环上两个取代基在对位,能与银氨溶液发生银镜反应;
③相同物质的量的K和A与NaOH溶液反应,消耗NaOH的量相同。
等质量的铜、铁、锌三种金属混合物Ag投入FeCl3与盐酸的混合溶液中,充分反应后:
(1)若无剩余固体,则溶液中的阳离子一定有、可能有。
(2)若剩余固体质量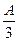 g,则溶液中的阳离子一定有、可能有、一定没有。
g,则溶液中的阳离子一定有、可能有、一定没有。
(3)若剩余固体质量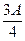 g,则溶液中的阳离子一定有、一定没有。
g,则溶液中的阳离子一定有、一定没有。
2001年1月6日,我国525名两院院士投票评选出1999年中国十大科技进步奖,其中一项是:储氢碳纳米管研究获重大进展。电弧法合成的碳纳米管,常伴有大量杂质——纳米颗粒。这种碳纳米颗粒可用氧化汽化法提纯。 其反应式是3C+2 K2Cr2O7+ 8H2SO43CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
其反应式是3C+2 K2Cr2O7+ 8H2SO43CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
(1)单线法标出电子转移的数目和方向。
(2)此反应的氧化剂是氧化产物是。
(3)H2SO4在上述反应中表现出来的性质是(填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生0.1mol气体物质,则转移电子的物质的量是mol.
(1)49gH2SO4的物质的量是,将其配制成200mL溶液,所得溶液的物质的量浓度为,其中含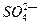 个,该溶液能与标准状况下的氨气L恰好完全反应生成(NH4)2SO4。
个,该溶液能与标准状况下的氨气L恰好完全反应生成(NH4)2SO4。
(2)由硫酸钾、硫酸铝和硫酸组成的混合溶液,其PH=1,c(Al3+)="0.4mol/" L, c(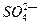 )="0.8" mol/ L, 则c(K+)为。
)="0.8" mol/ L, 则c(K+)为。
(3)将标准状况下a L HCl(g)溶于1000 g水中,得到盐酸的密度为bg/ cm3,则该盐酸的物质的量浓度是。
现有三种常见治疗胃病药品的标签:
① ② ③
这三种药品中所含的物质均能中和胃里过量的盐酸。
(1)某患者服用①药片2片后发生打嗝现象,请计算该患者服用该药片2片产生气体体积约mL。(体积按标准状况计)(2)若按每片药片中和胃酸的量来衡量药效,则每服用药片③1片,相当于服用药片②片。(精确到小数点后一位)
①NaOH溶液②铜丝③液态HCl④盐酸⑤稀硫酸⑥液氨⑦氨水⑧SO2⑨胆矾晶体⑩熔融NaCl⑾蔗糖晶体⑿酒精⒀酒精溶液
(1)上述状态下可导电的是_________________;
(2)于非电解质的是______________________;
(3)述状态下的电解质不能导电的是____________________。