碱式氯化铝[ Al2(OH)nCl6-n ] 是利用工业铝灰和活性铝矾土为原料(主要含Al、Al2O3、SiO2及铁的氧化物)经过精制加工而成,此产品活性较高,对工业污水具有较好的净化效果。其制备流程如下:
(1)原料需要粉碎,其目的是 ;滤渣I的主要成分是 ;
(2)步骤①在煮沸过程中,溶液逐渐变为浅绿色,此时溶液中呈浅绿色的阳离子常采用加入 试剂进行检验(填化学式);随后溶液又变为棕黄色,相关反应的离子方程式为 ;
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成碱式氯化铝;二是 ;已知碱式氯化铝的分散质粒子大小在1~100 nm之间,则区别滤液I与碱式氯化铝两种液体的物理方法是 ;若Ca(OH)2溶液过量,则步骤③得到的碱式氯化铝产率偏低,该反应的离子方程式为 ;
(4)某温度下若0.1 mol AlCl3溶于蒸馏水,当有2.5%水解生成Al(OH)3溶液时,吸收热量Q kJ ,该过程的热化学反应方程式为 。
工业制硫酸的过程中利用反应2SO2(g)+O2(g)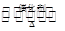 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收.请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收.请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,则下列说法正确的是.
| A.若反应速率v(SO2)=v(SO3),则可以说明该可逆反应已达到平衡状态 |
| B.保持温度和容器体积不变,充入2mol N2,化学反应速率加快 |
| C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大 |
| D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大 |
E.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| SO2 |
O2 |
SO2 |
O2 |
|||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
6 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为,表中y=.
②T1T2,(选填“>”、“<”或“=”),实验2中达平衡时 O2的转化率为.
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3.现有常温下0.1mol/L Na2SO3溶液,实验测定其pH约为8,完成下列问题:
①该溶液中c(Na+)与c(OH﹣)之比为.
②该溶液中c(OH﹣)=c(H+)++(用溶液中所含微粒的浓度表示).
③当向该溶液中加入少量NaOH固体时,c(SO32﹣),c(Na+).(选填“增大”、“减小”或“不变”)
下列框图所示的转化关系中,A、C均为常见的金属单质,A、C在冷的H的浓溶液中均会发生钝化;E为固体非金属单质。B为红色固体氧化物,X为常见的无色液体。L焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去)
请回答以下问题:
(1)含碳量在0.03 %~2 %之间的C的合金,是目前世界上使用量最大的合金,这种合金是;
A.铝合金 B.青铜C.镁合金 D.钢铁
(2)F的化学式为;
(3)I与氯气反应的离子方程式为;
(4)A与B生成C和D的反应是(填“放出”或“吸收”)大量热量的反应;
(5)D与L反应的离子方程式为。
(10分)化学学习中要注重对过程的分析,按要求回答下列问题:
(1)向石蕊试剂中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是__________、_________。
(2)将一小块钠投入到盛氯化铵的溶液中,有氨气生成,其反应过程分为两步,其中第二步反应的离子方程式为__________。
(3)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液到中性,写出发生反应的离子方程式________________;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式________。
a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化: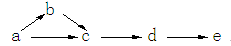
其中:a是单质;b是气体且为含氢化合物;c、d是氧化物;e是最高价含氧酸。
(1)如果a是一种淡黄色粉末固体,试推断:(用化学式表示):
a;b;e。写出由c生成d的化学方程式____________________________
(2)如果a为单质且是一种常见气体,试推断这五种物质(用化学式表示):
a;b;c;并写出由d生成e的化学方程式________________________
有机物A(分子式C6H10O3)是合成某种隐形眼镜材料的单体,A可发生如下变化: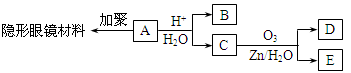
已知:Ⅰ.物质B是最简单的二元醇,已知两个羟基连在同一个碳上不稳定;物质D不能发生银镜反应,但能与NaHCO3溶液反应放出气体。
Ⅱ.
回答下列问题:
(1)隐形眼镜材料的结构简式为;
(2)写出物质B在铜催化下与O2反应的化学方程式;
(3)与C互为同分异构体,分子为链状的酯类物质共有种;