将l00mLl mol/L的Na2CO3溶液等分为两份.其中一份加入少许冰醋酸,另外一份加入少许Ba(OH)2固体,忽略溶液体积变化。两份溶液中c(CO32-)的变化分别是
| A.减小、减小 | B.减小、增大 | C.增大、增大 | D.增大、减小 |
关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的( )
| A.c(NH4+):③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(H+)=c(OH )+c(NH3•H2O) |
| D.①和③等体积混合后的溶液:c(NH4+)>c(Cl )>c(OH )>c(H+) |
我们主要从三个方面讨论一个化学反应的原理,其中不属于这三个方面的是( )
| A.反应进行的方向 | B.反应的快慢 | C.反应进行的限度 | D.反应物的多少 |
高温、催化剂条件下,某反应达到平衡,平衡常数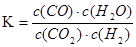 。恒容时,温度升高,H2浓度减小。下列说法正确的是()
。恒容时,温度升高,H2浓度减小。下列说法正确的是()
| A.该反应的焓变为负值 |
B.2CO2(g)+2H2(g) 2CO(g)+2H2O(g)的平衡常数K1=K2 2CO(g)+2H2O(g)的平衡常数K1=K2 |
| C.升高温度,正反应速率增大,逆反应速率减小,平衡正向移动 |
| D.若恒容、恒温下充入CO,则K值变大 |
下列说法正确的是()
| A.反应NH3(g)+HCl(g)="==" NH4Cl(s)在室温下可自发进行,则该反应的△H>0 |
| B.加热蒸干硫酸铝溶液的过程中促进了Al3+的水解,最终应该得到Al(OH)3沉淀 |
C.CH3COOH 溶液加水稀释后,溶液中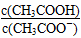 的值减小 的值减小 |
| D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH 减小 |
下列化学用语表述不正确的是()
A.水解方程式 HCO3- + H2O  H2CO3 + H3O+ H2CO3 + H3O+ |
B.水的电离 2H2O H3O+ + OH- H3O+ + OH- |
C.醋酸的电离方程式CH3COOH + H2O CH3COO- + H3O+ CH3COO- + H3O+ |
D.水解方程式 HCO3- + H2O H2CO3 + OH- H2CO3 + OH- |