能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,基态镍原子M层上的未成对电子数为 。
(2)大阪大学近日宣布,有机太阳能固体电池效率突破5.3%,而高纯度C60是其“秘密武器”。C60的结构如图1,分子中碳原子轨道的杂化类型为 ;1 mol C60分子中π键的数目为 。
(3)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图2。该结构中,碳氮之间的共价键类型有 (按原子轨道重叠方式填写共价键的类型),请在下图2中用箭头表示出配位键。
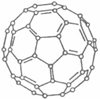
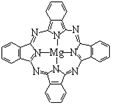
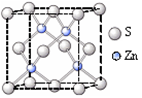
图1 图2 图3
(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As Se(填“>”、“<”或“=”)。
②硫化锌的晶胞中(结构如图所示),硫离子的配位数是 。

③二氧化硒分子的空间构型为 。
④砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为 。
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
能形成双原子气体分子,原子中有三个单电子 |
| X |
核外有5个能级,最高能级上只有1个电子 |
| Y |
最外层电子数是次外层电子数2倍 |
| Z |
最高正价为+7价 |
(1)写出元素Z的离子结构示意图__________。另有某元素M在地壳中的含量仅次于X,写出其+2价阳离子的电子排布式。
(2)X的硫酸盐与过量氢氧化钡反应的离子反应方程式为__________。
(3)COZ2俗称光气,其中碳氧原子之间的共价键有个σ键,个π键
(4)TH3的空间构型为 。(填“难”或“易”)溶于CCl4。
某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mgMg2+,则Mg2+的物质的量浓度为。
12.4gNa2X中含Na+0.4mol,则Na2X的摩尔质量是,X的相对原子质量是。
(12分) 工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)基态钛原子的核外电子排布式为。
(2)TiCl4在常温下呈液态,而FeCl3可用升华法提纯,则两种氯化物均属于晶体。
(3)SO42—和 S2O82—(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是。
A.SO42—中存在σ键和π键且与PO43—离子互为等电子体
B.S2O82—中存在非极性键且有强氧化性
C.S2O82—比SO42—稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是,原因是。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为,分子的空间构型为。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为。
(16分)尿素[CO(NH2)2]是首个由无机物人工合成的有机物。
⑴工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为。
⑵当氨碳比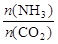 =4时,CO2的转化率随时间的变化关系如右图所示。
=4时,CO2的转化率随时间的变化关系如右图所示。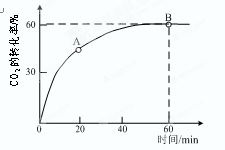
①A点的逆反应速率v逆(CO2)B点的正反应速率v正(CO2)(填 “大于”、“小于”或“等于”)
②NH3的平衡转化率为。
⑶人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如右图。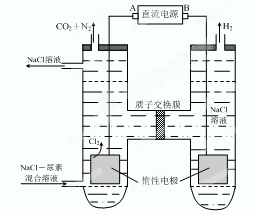
①电源的负极为(填“A”或“B”)。
②阳极室中发生的反应依次为、。
③电解结束后,阴极室溶液的pH与电解前相比将;若两极共收集到气体13.44 L(标准状况),则除去的尿素为g(忽略气体的溶解)。