下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去,常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属,其中E为年用量最大的金属。①、②均为工业上的重要反应.
请回答列问题:
(1)G ,K (填化学式).
(2)C原子结构示意图为 .
(3)写出B与C高温生成E和F化学方程式: 。
此反应叫 反应,可用于 。
(4)写出F与NaOH溶液生成L离子方程式:
(5)写出K溶液与E生成H离子方程式:
(1)同温同压下,同体积的甲烷(CH4)和CO2气体的分子数之比为;质量比为;原子总数之比为;氢原子数与氧原子数之比为。
(2)已知N2、CO2的混合气体的质量共12.0克,标准状况下 ,体积为6.72L,该混合气体的平均摩尔质量为;原混合气体中N2、CO2的体积之比为。
,体积为6.72L,该混合气体的平均摩尔质量为;原混合气体中N2、CO2的体积之比为。
(1)用离子方程式表示下列应用或现象
②小苏打与烧碱溶液的反应
②稀硫酸与氢氧化钡的反应
(2)根据下列离子方程式,各写一个符合条件的化学方程式
①Ag++Cl-=AgCl↓
②CO32─+ 2H+=CO2↑+ H2O
 在K2Cr2O7 + 14HCl="2KCl" + 2CrCl3 + 3Cl2↑+7H2O反应中,_________元素被氧化,_________是氧化剂,还原产物是,电子转移的数目是_________。
在K2Cr2O7 + 14HCl="2KCl" + 2CrCl3 + 3Cl2↑+7H2O反应中,_________元素被氧化,_________是氧化剂,还原产物是,电子转移的数目是_________。
①空气②氯气③氢氧化钠④熔融状态的硝酸钾⑤铁⑥葡萄糖⑦硫酸溶液⑧氯化铁溶液⑨酒精⑩硫酸铜(将序号填入下面划线中)
在以上物质中,属于 电解质的是___________,属于非电解质的是___________,
电解质的是___________,属于非电解质的是___________,
属于单质的是______________,属于混合物的是________________,能导电的 是_____ ______,属于酸的是___________,属于碱的是__________,属于盐(包括盐溶液)的是__________。
是_____ ______,属于酸的是___________,属于碱的是__________,属于盐(包括盐溶液)的是__________。
甲、乙两同学为探究 与可溶性钡的强酸盐能否反应生成白色
与可溶性钡的强酸盐能否反应生成白色 沉淀,用下图所示装置进行实验(夹持装置和A中加执装置已略,气密性已检验)
沉淀,用下图所示装置进行实验(夹持装置和A中加执装置已略,气密性已检验) 
实验操作和现象:
| 操作 |
现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 |
A.中有白雾生成,铜片表面产生气泡 B.中有气泡冒出,产生大量白色沉淀 C.中产生白色沉淀,液面上方略显红棕色并逐渐消失 |
打开弹簧夹,通入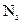 ,停止加热,一段时间后关闭 ,停止加热,一段时间后关闭 |
|
| 从B、C中分别取少量白色沉淀,加稀盐酸 |
均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是 。
。
(2)C中白色沉淀是。
(3)C中液面上方生成红棕色气体的化学方程式是。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气中的氧气参与反应,乙同学认为是白雾(硫酸酸雾)参与反应。
①为证实各自的观点,在原实验基础上;甲同学在原有操作之前通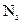 一段时间,目的是。乙同学在A、B间增加盛有饱和
一段时间,目的是。乙同学在A、B间增加盛有饱和 溶液的洗气瓶D,D中反应的离子方程式是。
溶液的洗气瓶D,D中反应的离子方程式是。
②各自进行实验,B中现象:
| 甲 |
大量不溶于稀盐酸的白色沉淀 |
| 乙 |
少量不溶于稀盐酸的白色沉淀 |
用离子方程式解释乙同学观察到的实验现象

(不必配平)。
(5)若将(4)中两同学的方案进行联合试验,发现B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是。