粉煤灰,是从煤燃烧后的烟气中收捕下来的细灰,粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物为:SiO2、Al2O3,还含有FeO、Fe2O3等。现将提取粉煤灰中Al、Si等元素,某科研小组的同学设计了如下工艺流程: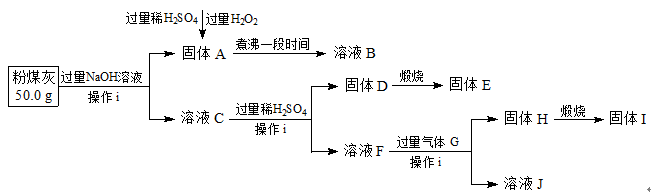
请回答下列问题:
(1)操作i所需要的玻璃仪器有: (填序号)。
a.铁架台 b.烧杯 c.冷凝管 d.玻璃棒 e.集气瓶 f.分液漏斗 g.漏斗
(2)写出粉煤灰与过量NaOH溶液反应的离子方程式 。
(3)写出向固体A中加入过量稀H2SO4和过量H2O2时发生的离子反应方程式 。
(4)写出生成固体H的离子方程式 。
(5)该科研小组的同学准备用0.1 mol·L-1KSCN溶液和0.5000mol·L-1KI溶液滴定溶液B,以测定粉煤灰中Fe元素的含量:
①为减小实验误差,由固体A制备溶液B过程中煮沸的目的是
(请用化学方程式表示)。
②判断滴定终点的现象为 。
③将溶液B配制成250mL溶液后,取出25.00mL装入锥形瓶中,再滴入1~2滴KSCN溶液进行滴定,滴定过程中使用KI溶液的量如下表所示:
| 滴定次数 |
1 |
2 |
3 |
4 |
| KI溶液体积/mL |
30.00 |
32.20 |
30.02 |
29.98 |
则该粉煤灰中Fe元素的质量分数为 (保留三位有效数字)。
④若滴定操作太慢,则滴定结果 (填“偏小”、“偏大”或“无影响”);原因是
(请用离子方程式及简单的文字描述)。
甲、乙、丙、丁、戊均为中学化学中常见的单质或化合物,且均含有同一种元素R,在一定条件下其转化关系如图所示。
(1)若R为一种非金属元素,且上述五种物质含右不同的官能团,丁为带水果香味的液体,乙和丁均能在碱性条件下生成甲,戊是一种无色气体,相同条件下戊相对H2的密度为14。
写出由甲生成戊的化学方程式,欲检验乙中官能团,所选用的试剂为(填序号)。
①NaOH溶液 ②Br2的CCl4溶液 ③银氨溶液 ④AgNO3溶液 ⑤稀HNO3
(2)若R为另一种非金属元素;甲与丙为常见大气污染物,且甲与丙的相对分子质量之差为1 6。丁为空气的主要成分之一。则丁的电子式为,乙的空间构型为。戊的稀溶液能跟过量铁粉反应,其离子反应方程式为。
6。丁为空气的主要成分之一。则丁的电子式为,乙的空间构型为。戊的稀溶液能跟过量铁粉反应,其离子反应方程式为。
(3)若R为一种金属元素,甲溶液的pH小于7,乙由两种元素组成,单质丁在二定条件下可生成戊。甲与戊两种溶液混合能生成沉淀丙,其离子方程式为,若镁粉中混有少量的丁,除去丁的离子方程式为。
(8分)将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5 min后达平衡状态,此时测得D的浓度为0.5 mol/L,混合气体的总体积为134.4 L(标准状况),C的平均反应速率为0.1 mol/(L·min).试求:
xC(g)+2D(g),经5 min后达平衡状态,此时测得D的浓度为0.5 mol/L,混合气体的总体积为134.4 L(标准状况),C的平均反应速率为0.1 mol/(L·min).试求:
(1)此时A的浓度c(A)=________mol/L,x的值为________;
(2)反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol;
(3)平衡时n(A): n(B): n (C): n(D) =
已知X、Y、Z都是短周期的元素,它们的原子序数依次递增。X元素所处的周期数、主族序数、原子序数均相等;Y的原子半径是其所在主族中最 小的,而
小的,而 Z原子的最外层电子数是其电子层数的三倍,Y和Z可以形成两种以上气态化合物,则
Z原子的最外层电子数是其电子层数的三倍,Y和Z可以形成两种以上气态化合物,则
(1) Y在周期表中的位置是第 ___周期第________族;
___周期第________族;
(2)由Y和Z组成,且Y和Z的质量比为7:8的化合物的化学式(或分子式)是 。
。
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是____和。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4︰2︰3,该盐的化学式(分子式)是。
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
 ⅢA ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1)在这些元素中,化学性质最不活泼的是:(填具体元素符号或化学式,下同)。
(2)在这些元素中,其最高 价氧化物的水化物中,酸性最强的化合物的分子式是,碱性最强的化合物的化学式是。
价氧化物的水化物中,酸性最强的化合物的分子式是,碱性最强的化合物的化学式是。
(3)最高价氧化物是两性氧化物的元素是;写出它最高价氧化物对应水化物与氢氧化钠反应的离子方程式。
(4)用电子式表示元素④与⑥形成化合物的形成过程:,
(5)表示③与①最高价态形成的化合物电子式,该化合物分子是
由(填“极性”“非极性”)键形成。
在 Li、
Li、 N、
N、 Na、
Na、 Mg、
Mg、 Li、
Li、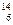 C中:
C中:
(1)和互为同位素。
(2)和 质量数相等,但不能互称同位素。
质量数相等,但不能互称同位素。
(3)和的中子数相等,但质子数不相等,所以不是同一种元素。