有机物A有如下转化关系,在A的质谱图中质荷比最大值为88,其分子中C、H、O三种元素的质量比为6:1:4,且A不能使Br2的CCl4溶液褪色;1mol B反应生成了2mol C.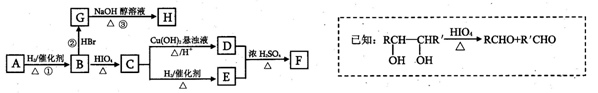
请回答下列问题:
(1)C—E的反应类型为 。
(2)若①,②、③三步反应的产率分别为93.0%、81.0%、88.0%,则由A合成H'的总产率为 。
(3)A的结构简式为 。
(4)写出C与银氨溶液反应的离子方程式为____。
(5)H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为 。
(6)X是A的一种同分异构体,且其核磁共振氢谱有3个峰,峰面积之比为1:1:2,1mol X可在HIO4加热的条件下反应,产物只有1mol Y,则X的结构简式为 。
以化学反应原理为依据,以实验室研究为基础,可以实现许多化工生产。
I分解水制取氢气的工业制法之一是“硫-碘循环法”,主要涉及下列反应:
分析上述反应,下列判断正确的是____。
循环过程中产生1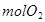 的同时产生
的同时产生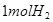
反应①中 还原性比
还原性比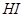 强
强
循环过程中需补充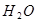
反应③易在常温下进行
在一定温度下,向2L密闭容器中加入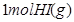 ,发生反应②.物质的量随时间的变化如图所示。
,发生反应②.物质的量随时间的变化如图所示。 内的平均反应速率
内的平均反应速率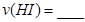
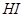 的转化率=_______
的转化率=_______
恒温恒容条件下,硫发生转化的反应过程和能量关系如图所示。 请回答下列问题:
请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式_______;
②恒温恒容时, 和
和 充分反应,放出热量的数值比
充分反应,放出热量的数值比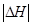 _____(填“大”、“小”或“相等”)
_____(填“大”、“小”或“相等”)
II.氮化硅(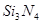 )是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:
)是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:
该反应平衡常数的表达式为K=_______.升高温度,其平衡常数
_________(填“增大”、“减少”或“不变”)。
(2)该化学反应速率与反应时间的关系如图所示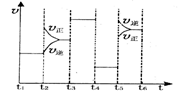
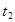 时引
时引 起突变的原因是_____,
起突变的原因是_____, 引起变化的因素是_____,
引起变化的因素是_____, 时引
时引 小变化、
小变化、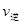 大变化的原因是_________.
大变化的原因是_________.
【原创】Ⅰ.(6分)将等物质的量的Fe2O3与FeCl3置于密闭管中加热,能恰好完全反应,且只生成一种产物X,其物质的量是反应物总物质的量的1.5倍,已知产物X难溶于水,易溶于强酸。
(1)产物X的化学式为 ;
(2)写出X溶于稀盐酸的离子方程式 ;
(3)某小组将X固体与足量钠在隔绝空气条件共热,发现有一种新的单质生成。设计实验证明这种单质。
。
【改编】Ⅱ.(12分)无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D。加热D发现无任何物质存在,把D溶于水测得溶液的pH小于7。已知气体C在标准状况下的密度为0.76g·L―1。
(1)A的化学式为 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
(3)1molSCl2能与2mol乙烯发生加成反应生成一种化学毒气芥子气,写出发生反应的化学方程式 。
(4)亚硝酸钠和D固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。
【改编】(15分)2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为: ΔH<0。在一定温度下,在一个体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。
ΔH<0。在一定温度下,在一个体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是 。
| A.在单位时间内生成1mol CO2的同时消耗了lmol CO |
| B.混合气体的密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 |
| D.混合气体的压强不再变化 |
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在下图中补充画出从t2到t4时刻正反应速率随时间的变化曲线: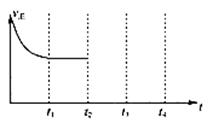
③若要同时提高该反应的速率和NO的转化率,采取的措施有 、 。(写出2个)
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应C(g) + H2O(g)  CO(g) + H2(g)ΔH=+131.3kJ·mol-1
CO(g) + H2(g)ΔH=+131.3kJ·mol-1
①该反应在 下能自发进行(填“高温”或“低温”)。
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为 。[已知:Ka1(H2S)=9.1×10-8,Ka2(H2S)=1.1×10-12;Ka1(H2CO3)=4.3×10-7, Ka2(H2CO3)=5.6×10-11]
(3)已知反应:CO(g)+H2O(g) CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需的时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1条件下平衡常数K= (保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是 。
③该反应的ΔH 0 (填“<”或“>”);若在900℃时,另做一组实验,在此容器中加入l0mol CO、5mo1 H2O、2mo1 CO2、5mol H2,则此时v(正) v(逆)(填“<”、“>”或“=”)。
Ⅰ.(18分)Ⅰ.A、B、C、D、E、F是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去):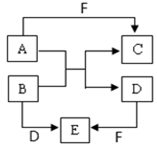
(1)若所有转化都是非氧化还原反应,B、D、E含有同种金属元素,F为强碱(部分产物略去),则B+D→E的离子方程式为 ,C为同周期元素构成的1∶1型化合物,则C的电子式为 。
(2) 若A、D、F为单质,B、C、E为化合物,B为两种非金属元素所组成的化合物,则E的化学式为 ,A+B→C+D的化学方程式为 。
Ⅱ.甲、乙都是二元固体化合物,将32g甲的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量Ba(NO3)2溶液,过滤、洗涤、干燥得沉淀46.6g;滤液中再滴加NaOH溶液,又出现蓝色沉淀。含乙的矿石自然界中储量较多,称取一定量乙,加入稀盐酸使其全部溶解,溶液分为A、B两等份,向A中加入足量氢氧化钠溶液,过滤、洗涤、灼烧得红棕色固体28g,经分析乙与红棕色固体的组成元素相同,向B中加入8.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体1.6g。
(1) 写出构成甲的阴离子的结构示意图 ;32g甲在足量浓硝酸中反应转移的电子数为 ;甲在足量氧气中充分灼烧的化学方程式为 。
(2)乙的化学式 ;稀硫酸溶解乙的化学方程式为 。
(3)将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为 ,设计实验证明此步反应后的溶液中金属元素的化合价 。
【化学—选修2:化学与技术】(15分)空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如下: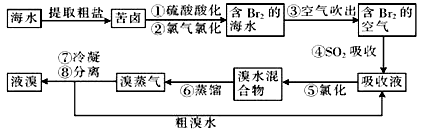
(1)目前,从海水中提取的溴约占世界溴年产量的 。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是 。
(3)步骤④的离子方程式为 。
(4)步骤⑥的蒸馏过程中,溴出口温度要控制在80〜90℃。温度过高或过低都不利于生产,理由是 。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差较大的特点进行分离。分离仪器的名称是 ,分离时液溴从分离器 (填“上口”或“下口")排出。
(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、S02吸收、氯化”的原因是 。
(7)某同学测得苦卤中溴的含量为0.8g/L,已知步骤①〜⑥中溴共损失了25%,步骤⑦和步骤⑧又共损失了所得溴蒸气的10%,若处理10 m3这样的苦卤,可得到液溴 mol。