化学活动日,小冉和老师共同完成以下酸和碱反应的探究实验。
(1)请依据上图完成实验:
| 实验步骤 |
实验现象 |
结论 |
| ①向烧杯中加入10ml氢氧化钠溶液,并滴入几滴酚酞溶液; ②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液。 |
①溶液颜色 ; ②不断搅拌溶液至溶液颜色恰好变成 为止。 |
该反应的化学反应方程式为 。 |
(2)小冉选取BaCl2、酚酞、紫色石蕊溶液设计实验,分别探究上述酸、碱反应后烧杯中的硫酸是否过量,请你根据下表判断正确的实验方案及分析方案错误的原因:
| 实验方案 |
实验步骤 |
实验现象 |
实验结论 |
| 方案一 |
取样,滴入适量的氯化钡溶液 |
出现白色沉淀 |
硫酸过量 |
| 方案二 |
取样,滴入几滴无色酚酞溶液 |
酚酞溶液不变色 |
酸、碱恰好反应 |
| 方案三 |
取样,滴入几滴紫色石蕊溶液 |
溶液变红 |
硫酸过量 |
①以上设计的三个方案中,有一个正确的方案是:方案 。
②请分析另外两个方案错误的原因: ;
。
化学兴趣小组的同学在实验室发现一瓶保管不当,盛有无色 溶液的试剂瓶,且标签破损(如图),其残缺的标签中只剩下“Na”字 样。老师告诉他们,这瓶溶液中的溶质可能是氢氧化钠、氯化钠或碳酸钠。同学们很感兴趣,决定对其成分进行探究。
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是(填字母代号)。
A.酸 B.碱 C.盐
【查阅资料】碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应。
【作出猜想】(1)可能是溶液;(2)可能是Na2CO3溶液;(3)可能是NaCl溶液。
【设计并实验】
| 实验 |
实验操作 |
实验现象 |
实验结论和解释 |
| I |
取样于试管中,向其中滴加几滴。 |
无色溶液变红 |
该溶液不可能是溶液,理由是。 |
| II |
另取样于试管中,向其中滴加足量的。 |
产生大量气泡 |
该溶液为碳酸钠溶液,有关反应的化学方程式为。 |
由此,同学们得出结论:该溶液是碳酸钠溶液。
【反思】老师指出该结论不严密。理由是:氢氧化钠溶液在空气中敞开放置,发生变质,能产生与实验Ⅰ和Ⅱ相同现象。老师提示,不需另取样,只要在实验Ⅰ后的试管中加入足量CaCl2溶液,若观察到现象,即可说明该溶液中有氢氧化钠。
化学兴趣小组对某品牌牙膏中碳酸钙含量进行以下探究。该牙膏摩擦剂主要由碳酸钙、氢氧化铝组成,其他成分遇到盐酸时无气体生成。现利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。请回答下列问题。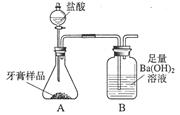
(1)装置A中牙膏样品放置在(填仪器名称)中,盐酸放置在装置(填仪器名称)中,A中至少发生(填数字)个反应,写出其中一个反应的化学方程式。
(2)若测定值比实际值小,可能的原因有。(填字母)
a.装置A中水蒸气、HCl等进入装置B中b.装置A中CO2未完全进入装置B
c.CO2气流速度太快导致Ba(OH)2未完全吸收d.盐酸未滴加过量
(3)为减少误差,现采取以下一些措施:
①在A、B之间增加一个装有(填化学式)溶液的洗气瓶,它的作用是 _;
②将装置B中的长导管下方增加一个带孔球泡,可以提高;
③在装置B的后面再增加一个装有(填药品名称或化学式)固体的干燥管,目的是。
(4)准确称取三份各16.00 g的样品,进行测定,测得BaCO3质量分别为3.96 g、3.92 g、3.94 g。请计算样品中碳酸钙的质量分数。。(写出计算过程,4分)
(5)某同学利用上述方法测定牙膏中钙元素的质量分数。小李同学认为即使排除实验仪器和操作的影响,上述测定的结果仍有可能偏小,理由是。
以下是我们日常生活中常用各种清洗剂,选择适当的用品可以得到更好的清洗效果。
| 名称 |
洗涤灵 |
洁厕灵 |
炉具清洁剂 |
污渍爆炸盐 |
漂白粉 |
| 产品样式 |
 |
 |
 |
 |
 |
| 有效成分或功能 |
清洗油污 |
盐酸 |
氢氧化钠 |
过碳酸钠 |
消毒 |
(1)我们使用洗涤灵清洗餐具上的油污,这是因为它具有的功能。
(2)以下物质可以使用洁厕灵清洗的是填字母序号)。
a.铁锈 b.油渍 c.水垢(主要成分为碳酸钙和氢氧化镁)
(3)取上述一定量的炉具清洁剂,滴加几滴酚酞溶液,溶液变色,若将洁厕灵与炉具清洁剂混合,可以发生右图所示的化学反应。图中a微粒的化学式为,在使用炉具清洁剂时应注意(写一点即可)。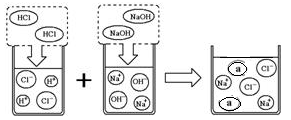
(4)“污渍爆炸盐”溶于水后会生成Na2CO3和H2O2。将爆炸盐溶于水后,再加入足量的洁厕灵,发生的化学反应方程式为。
(5)化学小组发现一袋包装破损的漂白粉,同学们对漂白粉其漂白作用是否失效产生了疑问。(当有效成分完全消失时,则漂白粉就完全失效;部分消失时,则为部分失效)。
I.查阅资料:
①漂白粉的主要成分是Ca(ClO)2、CaCl2和Ca(OH)2,其有效成分是Ca(ClO)2。
②Ca(ClO)2可溶于水,漂白原理是:它在空气中发生反应: Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,
③ HClO不稳定,易分解生成HCl和一种常见的单质气体。
④ CaCl2的水溶液呈中性,HClO的水溶液呈酸性。
⑤ HClO能可使有色物质(如:品红溶液)褪色。
II.交流讨论:
该小组同学经过分析得出:HClO分解时除生成HCl外,生成的另一种常见气体是。
III.实验探究: 下表是探究某漂白粉是否完全失效的实验,请根据表中结论,进行填空。
| 实验步骤 |
实验现象 |
实验结论 |
| 把少量漂白粉样品加入水中,通入足量的CO2气体,。 |
。 |
漂白粉的漂白作用已完全失效。 |
IV.继续探究:同学们对某完全失效后的漂白粉的成分很感兴趣,并作进一步探究。在老师的帮助下,同学们对该失效后的漂白粉成分进行猜想:
猜想一:CaCl2和CaCO3;猜想二:;
小明同学认为猜想中的成分CaCO3,除漂白粉的有效成分在空气中发生反应生成外,还有其它来源,请你用化学方程式表示。
小聪同学进行实验证明失效后的漂白粉的成分符合猜想一,而与猜想二不符。小聪同学的实验方案是:。
通过一学期的化学学习,同学们已经掌握了实验室制取气体的一些规律。请结合下图回答问题:
(1)写出图中标号的仪器名称:a_________,b_________;
(2)小李同学选用装置C,用高锰酸钾制取氧气。写出该反应的化学方程式_____;
用装置C还缺少的一种实验用品是_____,若用装置D收集的氧气不纯,其原因可能是_____(写出一种即可);用装置E收集氧气验满的方法是_____;
(3)若用双氧水(加少量二氧化锰)制取氧气,要得到平稳的氧气流,发生装置可选用上图中的_________(填字母编号)。二氧化锰的作用是__作用。
(4)通过查阅资料得知:氨气(NH3)是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水,小明同学加热氯化铵和氢氧化钙的固体混合物制取氨气时,她应选择的收集装置是_________(填字母编号);小芳将收集满氨气的试管倒扣在滴有无色酚酞试液的水中,观察到的现象是_________、_________;
小红为大家做了一个“燃纸成铁”的趣味实验.将一张滤纸(组成元素为C、H、O)用FeCl3浓溶液润湿,在酒精灯上烘干后点燃,滤纸变黑、红热,最终生成黑褐色物质.小红告诉大家:黑褐色物质中含有铁单质.
【提出问题】黑褐色物质中真的含有铁单质吗?
【探究过程】
(1)小红先从反应物分析,因为 所以反应后可能生成铁单质。
(2)为获得实验证据,小红做了实验1.
实验1:将黑褐色物质放入稀盐酸中,发现有连续微小气泡产生.若黑褐色物质中含有铁单质,则反应的化学方程式为 。
(3)小明提出疑问:由反应物的组成分析,能与稀盐酸反应产生气泡的物质不一定是铁单质,还可能是 。
小红通过查阅资料得知,在高温条件下不可能生成此类物质。
(4)小明仍有疑问:实验1中产生的气泡也可能是滤纸碳化后吸附的空气。
为此,小红又做了实验1的对比实验: 观察到有微小气泡产生但很快停止.证明实验1中的连续气泡确实是由铁单质与稀盐酸反应产生的。
(5)为进一步证明黑褐色物质中有铁单质,小红又做了实验2。
实验2:将黑褐色物质放入 溶液中,观察到 。
【得出结论】通过以上探究,证明黑褐色物质中确实含有铁单质.
【拓展探究】请再用一种方法证明黑褐色物质中含有铁单质: 。