用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略)
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是
(2)KMnO4氧化Fe2+的离子方程式补充完整:
(3)已知:生成氢氧化物沉淀的pH
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的 。
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 。
②Ⅳ中加入MnSO4的目的是 。
)化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置。
完成下列问题: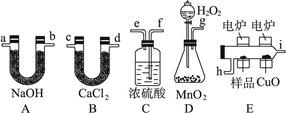
(1)按产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是
_;
(2)C装置中浓硫酸的作用是;
(3)D装置中MnO2的作用是;
(4)燃烧管中CuO的作用是;
(5)若准确称取9.0 g样品(只含C、H、O三种元素中的两种或三种)经充分燃烧后,A管质量增加13.2 g,B管质量增加5.4 g,则该有机物的实验式为____________________;
(6)要确定该有机物的分子式,还要。
Ⅰ、下列实验操作不正确的是 ;
①用分液漏斗分离环己烷和苯的混合液体
②将10滴溴乙烷加入到1 mL 10%的烧碱溶液中,加热片刻后,冷却,先加过量的硝酸,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
③分离苯和苯的同系物,可以采用蒸馏的方法。
④实验室制溴苯时选用的试剂可以是溴水、苯和铁屑
Ⅱ、为检验利用溴乙烷发生消去反应后生成的气体中是否含乙烯的装置如右图所示。回答:
(1)溴乙烷发生消去反应的化学方程式为:;
(2)试管a的作用是;
(3)若省去试管a,试管b中试剂为。
某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯。
请分析后回答下列问题
(1)关闭F夹,打开C夹,向装有少量苯的三颈烧瓶的A口加少量液溴,再加入少量铁屑,塞住A口,则三颈烧瓶中发生反应的化学方程式为
。
(2)D试管内出现的现象为。
(3)E试管内出现的现象为。
(4)三颈烧瓶右侧导管特别长,除导气外还起的作用是。
(5)待三颈烧瓶中的反应进行到仍有气泡冒出时松开F夹,关闭C夹,可以看到的现象是 ____。
(6)反应结束后将三颈烧瓶中的溴苯分离实验方法是。(铁屑已分离)
文献资料显示某地区的酸雨主要为硫酸型和盐酸型酸雨。某兴趣小组对酸雨进行实验研究:
(1) 提出合理的假设:该酸雨中的溶质除H2SO4、HCl外,该小组同学根据硫酸型酸雨的形成过程,预测主要溶质还一定有。
(2) 设计实验方案验证以上假设。在答题卡上写出实验步骤、预期现象和结论。
限选试剂及仪器:盐酸、硝酸、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用。 |
|
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤。 |
|
| 步骤3:取少量步骤2得到的滤渣加入足量的盐酸。 |
|
| 步骤4:取少量步骤2得到的的滤液,加入 。 |
|
| 步骤5:往B试管中加入 。 |
某化学研究性学习小组探讨Fe3+和 之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
甲同学认为发生氧化还原反应,其反应方程式为____________________________________。
乙同学认为发生双水解反应,其反应方程式为2Fe3++3 +6H2O===2Fe(OH)3(胶体)+3H2SO3。
+6H2O===2Fe(OH)3(胶体)+3H2SO3。
……
(2)实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是________。
②取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
(3)得出结论:
①根据丙同学的实验得出的结论是:____________________________。
②实验③中溶液变成血红色的有关离子方程式为________________________。
(4)拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是__________________________。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,两者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除 水解能力较
水解能力较 小外,还有________。
小外,还有________。