(1)碳、氮、氧的第一电离能大小顺序为 ,氧原子电子排布式为 。
(2)氨分子氮原子杂化类型 ,氨水中四种氢键哪一种是主要的 ,规律是什么? 。画出氢氟酸溶液中最主要氢键 。
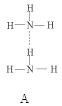
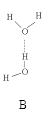
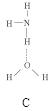

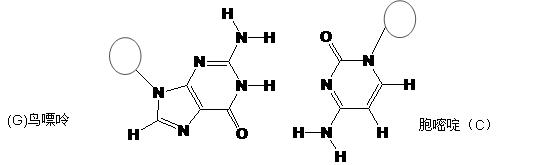
(3)DNA中四种碱基间通过氢键可能的配对方式,用虚线把氢键表示出来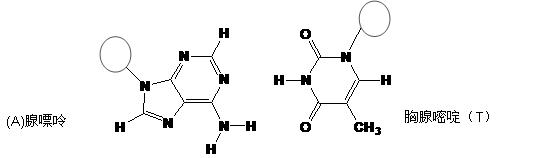
(4)试分析富马酸的K2大于其顺式异构体马来酸K2的原因。
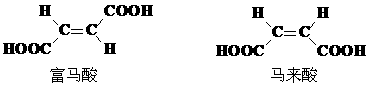
(5)下表是三种火箭推进剂的沸点,为什么火箭推进剂选择氮元素? 。
| 物质 |
H2 |
N2H4 |
H2NN(CH3)2 |
| 沸点/℃ |
-252.8 |
113.5 |
~116 |
(6)常压下,水冷却至0 ℃以下,即可结晶成六方晶系的冰。日常生活中见到的冰、霜和雪等都是属于这种结构,其晶胞如下图所示(只显示氧原子,略去氢原子),晶胞参数侧棱c=737 pm,菱形底边a=452 pm,底面菱形的锐角是60°。
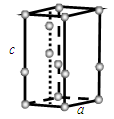
回答下列问题:
①计算晶胞中含有几个水分子。 ②计算冰的密度。
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/S |
X/mol |
Y/mol |
Z/mol |
 |
| 0 |
1.00 |
1.00 |
0.00 |
|
| 1 |
0.90 |
0.80 |
0.20 |
|
| 3 |
0.75 |
0.50 |
0.50 |
|
| 5 |
0.65 |
0.30 |
0.70 |
|
| 9 |
0.55 |
0.10 |
0.90 |
|
| 10 |
0.55 |
0.10 |
0.90 |
|
| 14 |
0.55 |
0.10 |
0.90 |
(2)体系中发生反应的化学方程式是______________
(3)列式计算该反应在0-3S时间内产物Z的平均反应速率:_______________
(4)该反应达到平衡时反应物X的转化率等于___________________________
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图所示)则曲线①、②、③所对应的实验条件改变分别是:① _______ ②______ ③______。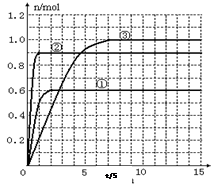
I.下列说法中正确的是_________。
A.制作航天服的聚脂纤维是新型无机非金属材料
B.肥皂可以用来去油污
C.金属的腐蚀属于物理变化
D.煤的气化属于化学变化
II.如图是找国科技工作者研制的以尿素为原料生产三聚氰胺(C3N6H6)的工艺——“常压气相一步法联产纯玻新技术”:
已知:①尿素的熔点是132.7℃ ,常压下超过160℃即可分解;②三聚氰胺的熔点是354℃,加热易升华,微溶于水。
请回答下列问题:
(1)以尿素为原料生产三聚氮胺的原理:____CO(NH2)2 ______C3N6H6+___NH3↑+__CO2↑
______C3N6H6+___NH3↑+__CO2↑
(配平化学方程式,在横线上填上相应物质的化学计量数),在实验室使尿素熔化的容器的名称为________。
(2)写出下列物质中主要成分的化学式:产品2_____、X_____ 。
(3)联氨系统沉淀池中发生反应的化学方程式为____________。
(4)为了使母液中析出更多的产品2,常用的方法是________。
A.加人NaOH固体 B.加入NaHCO3固体 C.通人CO2 D.通入NH3
氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:
N2(g)+3H2(g) 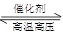 2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:
(1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数)
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 。
(3)45 min时刻改变的条件是 。
(4)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率从大到小的排列次序为 (平均反应速率分别以v1、v2、v3表示)。
(5)随着条件的改变,达到三次平衡时H2的转化率也发生[了变化,如分别以α1、α2、α3表示,其中最小的是 。
(6)请在图中用实线表示25~45、45~60min 两阶段化学平衡常数K的变化图像。
25℃时,有关物质的电离平衡常数如下:
| 化学式 |
CH3COOH |
H2CO3 |
H2SO3 |
| 电离平衡常数 |
K=1.8×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
K1=1.5×10-2 K2=1.02×10-7 |
(1)三种酸由强至弱的顺序为 (用化学式表示)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为 ,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者 后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+能力由大到小为 。
(4)c(NH4+)相同的下列物质的溶液中,物质的量浓度最大的是 。
A.NH4Al(SO4)2 B.NH4HCO3 C.NH4HSO4 D.NH4NO3 E.CH3COONH4
(5)等浓度的CH3COONa、NaHCO3的混合溶液中,各离子浓度关系正确的是 。
A.c(CH3COO-)>c(HCO3-)>c(OH-)
B.c(Na+)+c(H+) = c(CH3COO-)+c(HCO3-)+c(OH-)
C.c(OH-)>c(HCO3-)>c(CH3COO-)
D.c(CH3COO-)+c(CH3COOH) = c(HCO3-)+c(CO32-)
火箭推进剂由肼(N2H4)和液态过氧化氢组成,当它们混合反应时,即产生大量N2和H2O(g),并放出大量的热量。已知0.4mol液态肼与足量液态H2O2反应,生成N2和H2O(g)并放出256.65kJ热量。
(1)反应的热化学方程式为____________;
(2)反应中的氧化剂是_______;
(3)当放出256.65kJ热量时,转移电子数_______;
(4)此燃料的优点是____________________。