(14分)研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-484 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802 kJ·mol-1
则CH4(g)+CO2(g)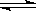 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1
(2)在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应
CH4(g)+CO2(g)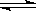 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。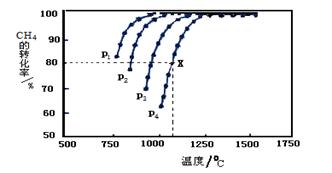
①据图可知,p1、p2、 p3、p4由大到小的顺序 。
②在压强为p4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为 。该温度下,反应的平衡常数为 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) 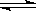 CO(g)+H2 (g)来制取。
CO(g)+H2 (g)来制取。
① 在恒温恒容下,如果从反应物出发建立平衡,可认定平衡已达到的是
| A.体系压强不再变化 | B.H2与CO的物质的量之比为1:1 |
| C.混合气体的密度保持不变 | D.气体平均相对分子质量为15,且保持不变 |
② 在某密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和一定量的C(s),如果此时对体系加压,平衡向 (填“正”或“逆”)反应方向移动,第5min时达到新的平衡,请在右图中画出2~5min内容器中气体平均相对分子质量的变化曲线。
在25 ℃、101 kPa的条件下,断裂1 mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,形成1 mol H—Cl键放出431 kJ能量。H2+Cl2===2HCl的化学反应可用下图表示: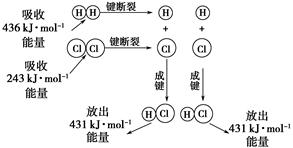
请回答下列有关问题:
(1)反应物断键吸收的总能量为________。
(2)生成物成键放出的总能量为________。
(3)判断H2+Cl2===2HCl是________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”,“=”或“<”)生成物的总能量。
A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素分别是:A________,B________,C________,D________。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是________。
(3)A与B形成的三原子分子的电子式是________,B与D形成的原子个数比为1∶1的化合物的电子式是________。
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是____________________________。
X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。请回答下列问题:
(1)元素X的名称是________,丙分子的电子式为________。
(2)若甲与Y单质在常温下混合就有明显现象,则甲的化学式为________。丙在一定条件下转化为甲和乙的反应方程式为___________________________。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为________(选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键
用电子式表示下列物质的结构:
(1)NH4Cl____________;(2)Na2O________________;(3)Na2O2________;(4)H2S________;(5)CO2________;(6)MgCl2________;
(1)~(6)中,仅含离子键的是________,仅含共价键的是________,既有离子键又有共价键的是________。
科学家发现:具有2、8、20、28、50、82、114、126等数目的质子或中子的原子核具有特别的稳定性,并将这些偶数称为“幻数”,而具有双幻数的 He、
He、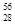 Ni、
Ni、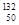 Sn、Pb等尤为稳定。根据此信息回答下列问题:
Sn、Pb等尤为稳定。根据此信息回答下列问题:
(1)写出前三种质子数为“幻数”的元素原子的结构示意图,并标明元素符号__________________。
(2)已知氧有三种同位素 O、
O、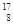 O、
O、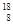 O,根据上述“幻数”规律,氧的同位素中原子核最稳定的是________。
O,根据上述“幻数”规律,氧的同位素中原子核最稳定的是________。
(3)根据现有元素周期律推算,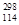 R位于元素周期表的第________周期第________族,核稳定性
R位于元素周期表的第________周期第________族,核稳定性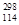 R__________
R__________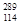 R(填“>”、“<”或“=”)。
R(填“>”、“<”或“=”)。