运用元素周期律分析下面的推断,其中错误的是 ( )
| A.砹(85号元素)是一种有色固体,HAt应该不稳定,且AgAt是有色难溶于水固体 |
| B.铍(Be)是一种金属,它的氧化物的水化物可能具有两性 |
| C.硫酸锶(SrSO4)是难溶于水和盐酸的的白色固体 |
| D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
下列实验过程中,始终无明显现象的是
| A.NO2通入FeSO4溶液中 | B.CO2通入CaCl2溶液中 |
| C.NH3通入AgNO3溶液中 | D.SO2通入Ba(NO3)2溶液中 |
下列现象或事实不能用同一原理解释的是
| A.浓硝酸和氯水用棕色试剂瓶保存 |
| B.硫化钠和亚硫酸钠固体长期暴露在空气中变质 |
| C.Cl2和SO2都能使品红溶液褪色 |
| D.SO2和Na2SO3溶液都能使溴水褪色 |
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-(其中碳元素为+2价)、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是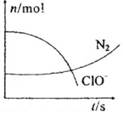
| A.还原剂是含CN-的物质,氧化产物只有N2 |
| B.氧化剂是ClO-,还原产物是HCO3- |
| C.配平后氧化剂与还原剂的化学计量数之比为5:2 |
| D.若生成2.24LN2(标准状况),则转移电子0.5mol |
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),下列有关说法不正确的是
| A.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将电能转化为化学能的过程 |
| B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
| D.除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: |
Na2CO3溶液→NaOH溶液→ BaCl2溶液→过滤后加盐酸
NH3是重要的化工原料,可以制备一系列物质(如图所示)。下列说法正确的是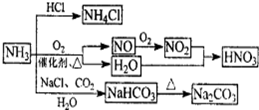
| A.NH4Cl和NaHCO3都是常用的化肥 |
| B.NH4Cl、HNO3和Na2CO3受热时都易分解 |
| C.NH3和NO2在一定条件下可发生氧化还原反应 |
| D.图中所涉及的盐类物质均可以发生水解反应 |