锗及其某些化合物是导弹火箭制导中的重要光电材料,工业上生产锗的流程如下: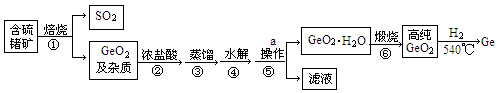
已知:GeO2与浓盐酸反应生成四氯化锗(熔点为—51.5℃,沸点为86.6℃)。四氯化锗易水解。
(1)步骤②中浓盐酸除了作为反应物外,还有一个重要作用是 。
(2)步骤③控制的温度范围 。
(3)写出反应的④、⑥的化学方程式
④ ;⑥ 。
(4)生产过程中可以循环利用的物质是 (填化学式)
(5)步骤①中产生的SO2可以用碱液吸收,请写出离子反应方程式 。
(6)请简要描述实验室中操作a的过程 。
布洛芬、非诺洛芬、酮洛芬是一类芳基丙酸类非甾体抗炎药,具有抗炎作用强、毒副作用低的药效特点。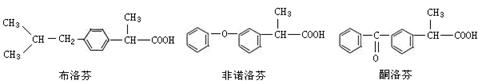
其中酮洛芬可由芳香族含氧衍生物A经以下路线合成得到: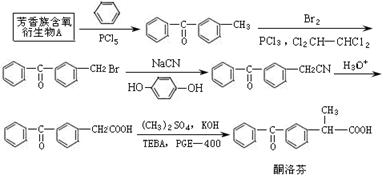
请根据合成酮洛芬的路线回答下列问题。
(1)已知有机物A可以与NaHCO3反应,则A的结构简式为。
(2)上述合成酮洛芬的路线中共有5步反应,其中属于取代反应的共有几步?。其中有一步反应中用到有机物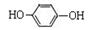 ,请写出实验室保存该有机物方法:。
,请写出实验室保存该有机物方法:。
(3) 布洛芬、非诺洛芬、酮洛芬都可视作2-苯基丙酸的衍生物,则芳香族含氧衍生物A与2-苯基丙酸的关系是;请写出满足下列条件的2-苯基丙酸的一种同分异构体的结构简式。
①苯的衍生物,且苯环上的一硝基取代物只有两种;②能与银氨溶液反应产生光亮的银境;③能与FeCl3溶液发生显色反应。
(4)参照上述合成路线中的有关信息,写出由对二甲苯为主要原料制备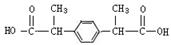 的合成流程图(无机试剂任选)。
的合成流程图(无机试剂任选)。
合成线路图示例如下:
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: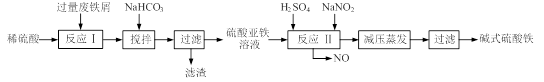
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)工业上常用一定浓度的纯碱溶液清洗铁屑,目的是。
(2)加入少量NaHCO3的目的是调节溶液的pH至 a,a的范围是。
(3)已知室温下,Al(OH)3的Ksp=1.3×10-33,当pH=5时,溶液中c(Al3+)=
(4)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为;O2参与反应的离子方程式为
(5)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为。
氯气是一种重要的工业原料。
Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是。
Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:
Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O
2CaSO4+2Cl2↑+2H2O
他们利用该反应设计如下制取氯气并验证其性质的实验。
(1)回答下列问题:(1)该实验中A部分的装置是(填标号) 。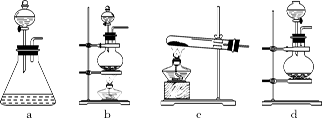
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):。
(3)写出D装置中发生反应的离子方程式(4)该实验存在明显的缺陷,请你提出改进的方法。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取出25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L−1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2 === Na2S4O6+2NaI,共用去Na2S2O3溶液20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为。
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是;
A.品红溶液B.紫色石蕊溶液 C.酸性KMnO4溶液D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为:;
(3)过程③中,需加入的物质是;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有
;
(5)过程⑤调节pH可选用下列试剂中的(填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.00g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为2.33g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为。(假设杂质中不含铁元素和硫元素)。
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知: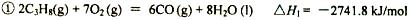

(1)反应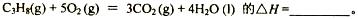
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化
b.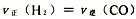
c.混合气体的平均相对分子质.量不发生变化
d.CO2的浓度不再反生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)=。
③向平衡体系中充入少量CO则平衡常数____(填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由____极移向____极(填“正”或“负”);电池的正极电极反应式为。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____。