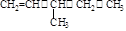(本题共14分)X、Y、Z、W为短周期的主族元素,其原子序数依次增大。X元素形成的单质是自然界中含量最多的气体。Y是电负性最大的元素。W的原子最外层电子数与核外电子总数之比为3∶8。X的原子序数是Z的原子序数的一半。U原子基态的外围电子排布为3d104s1。
(1)Z基态的核外电子排布式 ,U在周期表中位置为 。
(2)在Y的氧化物OY2中,氧原子的杂化轨道类型是 。
(3)在银氨溶液中通入W的气态氢化物,会出现黑色沉淀,该反应的离子方程式是 。
(4)1molX的气态氢化物在800~900℃下催化氧化放出226.25KJ热量。该反应的热化学方程式为 _ 。
(5)U的含氧化合物M晶胞如右图所示(“○”表示氧原子),则M的化学式为 ;氧原子的配位数为 。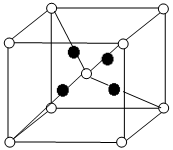
(1)水是生活中不可缺少的物质,A是短周期有色气态单质,B是短周期元素组成的固态有色化合物,A与B都可与水发生氧化还原反应,反应中水既不作氧化剂也不作还原剂。请写出A、B分别与水反应的化学方程式:_________________,______________
(2)NaAlO2的水溶液呈碱性,其呈碱性的原因是(用必要的文字和离子方程式表示)_____________
(3)NaNH2可由金属钠与液氨反应得到,遇水产生两种碱。写出NaNH2与水反应的化学方程式__________
(4) 已知常温下AgCl与AgI的溶度积分别是1.0×10-10和1.5×10-16。若向200 mL饱和AgCl溶液中加入等体积的KI溶液,为使饱和溶液中产生AgI沉淀,则所需加入的KI溶液的物质的量浓度最小是______________。
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。完成下列各题:
(1)正四面体烷的二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法正确的是________。
| A.能使酸性KMnO4溶液褪色 |
| B.1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应 |
| C.乙烯基乙炔分子内含有两种官能团 |
| D.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同 |
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子发生加聚反
应的化学方程式
(4)写出与苯互为同系物且一氯取代产物只有两种的物质的结构简式
(举两例):__________________、__________________。
卤代烃在碱性醇溶液中能发生消去反应。例如:
下图是八种有机化合物的转换关系。
请回答下列问题:
(1)上述框图中,属于消去反应的是(填序号).
(2)①是______________(填反应类型),
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:
___________________________________________________。
(4)C2的结构简式是__________________。
F1的结构简式是________________。
F1和F2互为________________。
(5)上述八种化合物中,属于二烯烃的是________。
二烯烃的通式是________。
已知某烃类化合物A的相对分子质量为84:
(1)若分子中含有一个碳碳双键,且分子中只有一种类型的氢原子
A的结构简式为
A中的碳原子是否都处于同一平面?(填“是”或者“不是”)。
(2)若分子中无碳碳双键,且分子中只有一种类型的氢原子
A的结构简式为
其名称为
请根据官能团的不同对下列有机物进行分类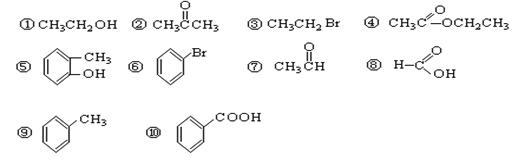
(1)芳香烃: ;(2)卤代烃:;
(3)醇: ;(4)酚: ;(5)醛: ;
(6)酮: ;(7)羧酸: ;(8)酯:。
(Ⅱ)
⑴键线式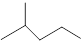 表示的分子式。
表示的分子式。
⑵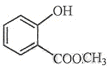 中含有的官能团的名称为。
中含有的官能团的名称为。
⑶书写该物质的名称: