已知:(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下: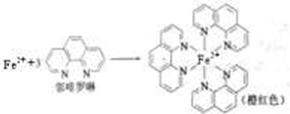
4FeCl3+2NH2OH·HCl 4FeCl2+N2O↑+6HCl+H2O
4FeCl2+N2O↑+6HCl+H2O
①Fe2+在基态时,价层电子排布式 。 ②羟胺(NH2OH)中N原子的杂化方式 。
③Fe2+与邻啡罗啉形成的配合物中,配位数为 。
(2)硫酸铜晶体的化学式也可以表达为Cu(H2O)4SO4·H2O晶体,该晶体中含有的化学键类型是
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、磷化镓及铜锢硒薄膜电池等。 其中元素P、As、Se第一电离能由小到大的顺序为: 。

图1 图2
(4)① 有机太阳能固体电池材料含有高纯度C60,其结构如图1,则1 mol C60分子中π键的数目为 ,C60的晶胞结构如图2,则其配位数为_______若此晶胞的密度为ρg/cm3则两个最近C60间的距离为________cm(列式表达,已知阿伏伽德罗常数为NA)
② 如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。若每个四面体空隙填入一个原子,则全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为 。
工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca,Mg元素)为原料生产碳酸锂。其部分工业流程如下:
已知:①Li2O·Al2O3·4SiO2 + H2SO4(浓) Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
②某些物质的溶解度(S)如下表所示。
| T/℃ |
20 |
40 |
60 |
80 |
| S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
| S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3部分的流程如下图所示,括号表示加入的试剂,方框表示所得的物质。则步骤Ⅱ中反应的离子方程式是______________________________。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)_____________________________。
(3)最后一个步骤中,用“热水洗涤”的目的是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________。
②电解后,LiOH溶液浓度增大的原因_____,b中,生成Li2CO3反应的化学方程式是_______。
(5)磷酸亚铁锂电池总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+试写出该电池放电时的正极反应:__________________。若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为__________________。
LiFePO4,电池中的固体电解质可传导Li+试写出该电池放电时的正极反应:__________________。若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为__________________。
甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 |
平衡常数 |
温度(℃) |
|
| 500 |
800 |
||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) |
K1 |
2.5 |
0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) |
K2 |
1.0 |
2.50 |
③3H2(g)+ CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) |
K3 |
(1)反应②是(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”、“<”或“=”)。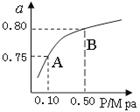
(3)据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示)。在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正)v(逆)(填“>”“=”或“<”)
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,
已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。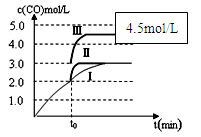
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是。
A、B、C、D、E是原子序数由小到大排列的五种短周期元素,其中A、B、C、D的原子序数之和为32,A是元素周期表中原子半径最小的元素,B、C左右相邻,C、D位于同主族.
(1)E元素原子的结构示意图为:,写出一个能证明D、E两元素非金属性强弱的事实或反应方程式:.
(2)A与C组成的化合物的电子式为,其中含有的化学键为(填“极性键”“非极性键”“离子键”).(若有多种可能,只需答出其中一种物质)
(3)A、B、C、D四种元素中的三种能组成一种强酸,该强酸的稀溶液能与铜反应,其中起氧化性作用的酸占消耗酸总物质的量的百分比是.
(4)由A、B、C、D四种元素组成的一种离子化合物X.
①已知1mol X能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下X与NaOH浓溶液反应的离子方程式:.
②又知X既能与盐酸反应,又能与氯水反应,写出X的化学式:.
(9分)
(1)请用下列10种物质的序号填空:①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:______________;若XY2为共价化合物时,其结构式为:__________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103 Pa),但在180℃就开始升华,据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是______________________________________________。
(4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:
①元素的原子间反应最容易形成离子键的是________(填序号,下同),容易形成共价键的是______;
| A.c和f | B.b和g | C.d和g | D.b和e |
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式______。
(9分)
(1)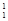 H、
H、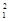 H、
H、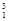 H互为________,16O2、18O3互为________。
H互为________,16O2、18O3互为________。
| A.同位素 | B.相同物质 |
| C.同素异形体 | D.同分异构体 |
(2)某元素的最高价氧化物分子式R2O5,已知R的气态氢化物中含氢8.82%,则R的相对原子量约为________,R元素周期表中的位置为________________。
(3)铷和另一种碱金属形成的合金7.8 g与足量的水反应后,产生0.2 g氢气,则此合金中另一碱金属可能是:________________。(铷的相对原子量取85.5)
(4)质量相同的H2O和D2O与足量钠反应,放出的气体在标况下的体积之比为________。