(14分)以下几种物质是常用香精的主要成分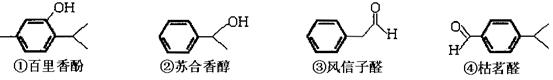 请回答下列问题:
请回答下列问题:
(1)百里香酚和苏合香醇都能发生的有机反应类型有 :(填序号)
①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤缩聚反应
(2) 写出风信子醛与新制氢氧化铜反应的化学方程式_______________________________________________;
(3)己知醛在一定条件下可以两分子加成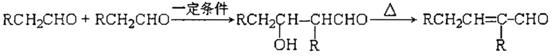
兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香。由枯茗醛合成兔耳草醛的路线如下: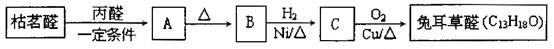
①写出A的结构简式
②设计实验方案检验有机物B中的无氧官能团
③写出C→兔耳草醛的化学方程式
④符合下列条件的A的同分异构体有 种。
i.苯环上有两个取代基,其中一个取代基为-CH(CH3)2
ii.能发生水解反应,水解产物之一能与FeCl3溶液发生显色反应。
写出符合上述条件,且核磁共振谱显示有6种氢的结构简式 。
假定元素周期表是有限的,根据已知的元素周期表的某些事实和理论可归纳出一些假说。
(1)根据每个周期最后一种金属元素出现的族序数,预测周期表中原子序数最大的金属元素将在________周期,________族(注:把0族看作ⅧA族)。周期表元素在填满________周期后将结束。
(2)根据周期表中每个周期非金属元素的种数(把稀有气体元素看作非金属元素),预测周期表中应该有__________种非金属元素,还有__________种没发现。没发现的非金属元素处于__________周期__________族。
如右图所示,已知A元素的最低化合价为-3,它的最高价氧化物含氧56.34%,原子核内中子数比质子数多一个。试完成下列问题:
(1)写出它们的元素符号:
A_________,B_________,C_________,D_________,E_________。
(2)它们的气态氢化物稳定性最弱的是_________。
(3)A、B、C三元素最高价氧化物对应水化物的酸性由强到弱的顺序是_________。
现有A、B、C、D四种元素,A、B元素的原子各有两个电子层,C、D各有三个电子层;A与B能化合成无色、无味的气体AB2;1 mol C单质与0.5 mol D单质能形成离子化合物C2D;B和D同主族,B的离子和C的离子核外电子数相等。试推断这四种元素的名称。
某同学在画某种元素的一种单核微粒的原子结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示作出自己的判断。
(1)该微粒是中性微粒,这种微粒的符号是__________。
(2)该微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒的符号是__________。
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种微粒的符号是__________。
(4)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种微粒的符号是__________。


(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
(2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量。
(3)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的____________,请写出元素在元素周期表中的位置与元素原子结构的关系:__________________________。