2014年央视 “3.15”晚会上曝出某品牌金饰品掺假的事件,引起同学们的好奇。小明同学拿来一片黄色的金属,和小军同学一起进行了相关探究活动。
【猜 想】①小明认为是黄金 ②小军认为是铜锌合金
【设计实验】
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取一小片黄色金属放在石棉网上用酒精灯加热 |
黄色的金属变黑 |
| ② |
取一小片黄色的金属放入稀硫酸中 |
|
【得出结论】
(1)由实验①可知,猜想 (填序号)正确;写出反应的化学方程式
。
(2)实验②中的现象是 ,写出反应的化学方程式
。
【反思应用】假设你的观点和小军相同,请你选用一种类别不同于稀硫酸的试剂,再设计一个实验:取一小片黄色的金属放入 溶液中,实验中观察到的现象是 。
(7分)某化学兴趣小组的同学对碳酸钙高温加热一段时间剩余固体的成分进行探究。
【提出问题】剩余固体成分是什么?
【猜想与假设】剩余固体成分为:
A.全部是碳酸钙
B.既有碳酸钙也有氧化钙
C.全部是氧化钙
【设计并完成实验】
| 实验操作 |
实验现象 |
实验结论, |
| (1)取少量固体试管中,加适量水震荡后静置,再滴几滴无色酚酞溶液 |
溶液变红 |
说明固体成分中一定含有 |
| (2)再取少量固体另一试管中滴加过量稀盐酸 |
有气泡产生 |
说明固体成分中一定含有 |
【实验结论】该化学兴趣小组得出的结论是:剩余固体成分与【猜想与假设】中的(填“A”或“B”或“C”)相符合。
【交流与反思】实验操作产生的气体是,剩余固体的成分若与C相符,则两步操作的实验现象与(填“(1)”或“(2)”或“(1)(2)”)不同。写出操作(1)中发生反应的化学方程式。
某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会儿后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ、写出该中和反应的化学方程式:。
Ⅱ、探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2;
猜想二:可能只有CaCl2;
猜想三:。
【查阅资料】氯化钙溶液呈中性。
【进行实验】实验步骤1:取少量烧杯内溶液加入试管中,滴加几滴酚酞溶液,振荡。
实验现象1:。结论:猜想一不正确。
实验步骤2:取少量烧杯内溶液加入另一支试管中,逐滴加入碳酸钠溶液至过量。
实验现象2:。结论:猜想二不正确,猜想三正确。
【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑。
(2)验证烧杯内溶液中的溶质含有HCl,除以上方案外,
下列哪些物质或方法单独使用也能完成该实验?(填序号)
a.pH试纸 b.检查导电性 c.镁条 d.硝酸银溶液
(3)要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的。
小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究。
【探究目的】探究所得溶液的酸碱性
【提出猜想】所得溶液可能呈碱性,也可能呈酸性,还可能呈中性。
【实验验证】
| 实验操作 |
实验现象 |
结论 |
| 用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 |
无色酚酞试液变 |
溶液呈碱性 |
| 无色酚酞试液不变色 |
溶液呈 |
【分析与思考】
(1)若溶液呈碱性,则溶液中使其呈碱性的离子是(填写微粒符号)。
(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到,则所取溶液呈酸性;若无明显现象,则呈中性。
方案二:取样,加入金属锌,若有所泡产生,则所取溶液呈酸性,该反应的化学方程式为;若无明显现象,则呈中性。
在化学实验室,某小组同学实验时发现一瓶没有密封好的NaOH已经结块。于是对其成分进行科学探究,请你一起完成探究的过程。
Ⅰ固体的成分分析
【提出问题】结块后的固体成分是什么?
【猜想与假设】
猜想一:固体为碳酸钠
猜想二:固体为碳酸钠和氢氧化钠。
用化学方程式表示固体中有碳酸钠的原因_____________________________________。
【查阅资料】BaCl2溶液pH=7
【实验探究】从瓶中取出一定量的固体,加入足量水溶解,再将溶液分三等份分别装入A、B、C三支试管,进行如图所示实验。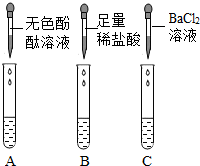
甲同学根据实验现象,认为结块固体中有碳酸钠和氢氧化钠。
【实验分析】
(1)根据甲同学的实验结论可知,三支试管中观察到的实验现象分别为:A试管中________________,B试管出现大量气泡,C试管中出现白色沉淀;
C试管中现象产生的原因是(用化学方程式表示)___________________________。
(2)乙同学认为甲同学的结论是不正确的,原因是_______________________________。
【实验设计】请你设计合理的实验方案,填入下列表格中。
| 操作 |
现象 |
结论 |
| 取少量结块固体于试管(或烧杯)中,加水使其完全溶解,__________________ ______________________ _____________________ |
_______________________ |
固体为碳酸钠和氢氧化钠 |
Ⅱ固体中各成分含量
为确定该固体样品中Na2CO3的质量分数,小芳同学称取2 g样品,利用A为Y形管、B为量气管、C为水准管作为主要反应容器,进行了如图(I)所示实验。
(1)在量气管内水面上架一薄层油,目的是__________________________。
(2)使样品与稀硫酸反应的操作为 __________________________________。
(3)实验结束后,小芳同学读出量气管中的气体体积为22.4ml(已知该温度压强下,CO2的密度为1.965 g/L),请你计算出样品中Na2CO3质量分数。(写出计算过程)
(4)小明同学设计如图(Ⅱ)装置,分别测定反应前、反应后仪器以及仪器内物质的总质量,进行有关计算,实验操作中没有失误,多次测量的结果均偏大,你认为可能的原因是________________________。
两个化学兴趣小组分别进行以下3个实验:
①MgSO4溶液和NaOH溶液反应;
②稀H2SO4和BaCl2溶液反应
③稀HCl和NaOH溶液反应(用酚酞试液作指示剂)
实验结束后,同学们发现本组废液缸里废液颜色与另一小组不一样,在征得老师同意后,两组同学各自对本小组的废液进行探究:
【提出问题】废液缸里的废液成分有什么?
【查阅资料】微溶物质在反应物中视作可溶物,在生成物中视为不溶物。
【实验探究】
(一)第1小组的探究:
1.小东首先把呈浑浊状态的废液进行分离,得红色澄清滤液和滤渣。
2.小刚认为无需进行实验,就能判断出滤渣中含有BaSO4、Mg(OH)2两种沉淀,他的理由是,请你写出生成其中一种沉淀的化学方程式:。
3.小西对滤液成分(除酚酞、水外,下同)进行分析,认为滤液中一定含NaOH和NaCl,并对可能有的成分提出如下猜想:
猜想1:滤液中含有BaCl2
猜想2:滤液中含有Na2SO4
猜想3:滤液中含有BaCl2、Na2SO4
(1)小强认为猜想3是不成立的,因为;
(2)小雨取少量滤液于试管中,滴加溶液,出现的现象是,证明猜想2成立。
(二)第2小组的探究:
第2小组首先对废液进行了分离,得无色滤液和少量滤渣,然后取少量滤液于试管中,逐滴滴加Na2CO3溶液,并根据实验结果绘制成下图。请据此判断,滤液一定含有的离子是(填离子符号),实验过程中滤液颜色的变化为。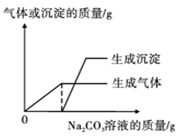
【交流反思】实验结束后,同学们一致认为实验后的废液要进行处理才能排放,否则会对环境造成污染。