碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为
。
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为 11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
则溶液中铁元素的总含量为 g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会
(填“偏高” “偏低” “不变”)
【化学—化学与技术】
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。
(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
加入冰晶石的作用为_______________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________,下列可作阴极材料的是______。
a.铝材b.石墨c.铅板d.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式_______________________。在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(4)下列说法正确的是__________________。
a.阳极氧化是应用原电池原理进行金属材料表面处理的技术
b.铝的阳极氧化可增强铝表面的绝缘性能
c.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
d.铝的阳极氧化膜富多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)制取金属锌的流程如图所示。
(1)提高酸浸效率的措施为_________________________________(任答一条即可);酸浸时H+与难溶固体ZnFe2O4反应的离子方程式为___________________。
(2)净化Ⅰ中H2O2参与反应的离子方程式为____________________________;X可选择的试剂为______(写化学式)。净化Ⅱ中Y为_____________(写化学式)。
(3)电解法制备锌的装置如图甲所示:
则电解槽中盛有的电解质溶液为______(填字母)。
a.ZnCl2溶液b.Zn(NO3)2溶液c.ZnSO4溶液
根据图甲中的数据,可求得电解过程中电流的有效利用率为_________。
(4)使用含有[Zn(OH)4]2-的强碱性电镀液进行镀锌防腐蚀,可得到细致的光滑镀层,电镀时阴极电极反应式_____________________。以锌为负极,采用牺牲阳极法防止铁闸的腐蚀,图乙中锌块的固定位置最好应在_____处(填字母)。
研究氮的固定具有重要意义。
(1)雷雨天气中发生自然固氮后,氮元素转化为________而存在于土壤中。处于研究阶段的化学固定
新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H K①
已知:N2(g)+3H2(g)=2NH3(g)△H1=-92.4kJ·mol-1 K1②
2H2(g) +O2(g) =2H2O(l)△H2=-571.6kJ·mol-1 K2③
则△H =________;K=___________(用K1和 K2表示)。
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3h,实验数据见下表:
| 序号 |
第一组 |
第二组 |
第三组 |
第四组 |
| t/℃ |
30 |
40 |
50 |
80 |
| NH3生成量/(10﹣6mol) |
4.8 |
5.9 |
6.0 |
2.0 |
下列能说明反应①达到平衡状态的是_____(填字母)。
a.NH3和O2的物质的量之比为4∶3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为___________;第四组反应中以NH3表示的反应速率是__________________,与前三组相比,NH3生成量最小的原因可能是_________________。
(3)美国化学家发明一种新型催化剂可以在常温下合成氨,将其附着在电池的正负极上实现氮的电化学固定,其装置示意图如下: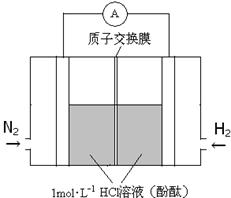
则开始阶段正极反应式为_____________;忽略电解过程中溶液体积变化,当电池中阴极区溶液pH = 7时,溶液中NH3·H2O的浓度为___________( Kb=2×10-5mol·L-1);当电池中阴极区呈红色时,溶液中离子浓度由大到小的顺序为_________________。
【化学——有机化学基础】
下述反应是有机合成中常见的增长碳链的方法:
(1)有关化合物I的说法正确的是________。
| A.可发生取代、氧化等反应 |
| B.1mol化合物I最多能与4mol H2加成 |
| C.易溶于水、乙醇等溶剂 |
| D.属于芳香族化合物 |
(2)化合物Ⅱ的分子式为__________,lmol化合物Ⅱ与NaOH溶液反应最多消耗_____________mol NaOH.
(3)化合物III可与乙酸制备化合物Ⅱ,写出符合下列要求的III的同分异构体的结构简式______________.
a:遇FeCl3溶液显紫色b:核磁共振氢谱有3组峰
(4)利用此增长碳链的方法,写出以甲苯为原料,制备 的化学方程式_____________________,_____________________。
的化学方程式_____________________,_____________________。
【化学—物质结构与性质】
碳是形成化合物种类最多的元素。
(1)C、N、O三种元素的第一电离能由大到小的顺序为______,碳的最简单气态氢化物中心原子的杂化类型为___________。
(2)类肉素[(SCN)2]的结构式为N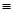 C—S—S—C
C—S—S—C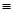 N。其分子中
N。其分子中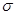 键和
键和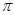 键的个数比为__________;该物质对应的酸有两种,理论上硫氰酸(H—S—C
键的个数比为__________;该物质对应的酸有两种,理论上硫氰酸(H—S—C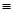 N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是___________________。
N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是___________________。
(3)位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同的元素,其基态原子的价层电子排布式为 ____________。
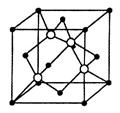
(4)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能,其晶胞结构如图所示(其中·为碳原子,○为硅原子)。每个碳原子周围与其距离最近的硅原子有_____个;设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为__________(用含a、b的式子表示).