某研究小组想研究碳与浓硝酸的反应。其实验过程如下。
| 操作 |
现象 |
| a.用干燥洁净的烧杯取约10 mL浓硝酸,加热。 |
|
| b.把小块烧红的木炭迅速伸入热的浓硝酸中。 |
红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
①碳与浓硝酸的反应,说明浓硝酸具有 性。
②反应产生的热量会使少量浓硝酸受热分解,写出反应的化学方程式 。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。小组同学为了研究助燃气体是O2还是NO2,设计了以下实验。
Ⅰ.制取NO2气体。
①在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。
②NaOH溶液的作用是吸收多余的NO2,反应生成两种物质的量相等的正盐,写出这两种盐的化学式 。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
①根据实验现象写出碳与NO2气体反应的化学方程式 。
②试分析:是否需要增加带火焰的木炭与纯净O2反应的实验 。
③通过实验探究,你认为助燃气体是什么,简述理由 。
二氧化氯(
,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问題:
(1)工业上可用
与
在
存在下制得
,该反应氧化剂与还原剂物质的量之比为。
(2)实验室用
、盐酸、
(亚氯酸钠)为原料,通过以下过程制备
:
①电解时发生反应的化学方程式为。
②溶液
中大量存在的阴离子有。
③除去
中的
可选用的试剂是(填标号)。
a.水 b.碱石灰C.浓硫酸 d.饱和食盐水
(3)用下图装置可以测定混合气中
的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50
水溶解后,再加入3
稀硫酸:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000
硫代硫酸钠标准溶液滴定锥形瓶中的溶液(
),指示剂显示终点时共用去20.00
硫代硫酸钠溶液。在此过程中:
①锥形瓶内
与碘化钾反应的离子方程式为。
②玻璃液封装置的作用是。
③
中加入的指示剂通常为,滴定至终点的现象是。
④测得混合气中
的质量为
。
(4)用
处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是(填标号)。
a.明矾b.碘化钾c.盐酸 d.硫酸亚铁
废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下: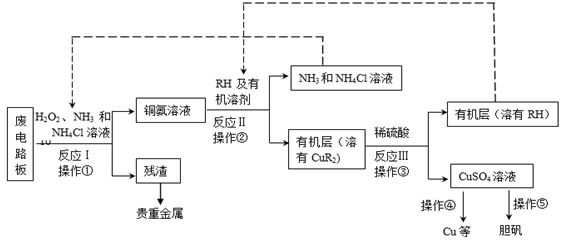
回答下列问题:
(1)反应Ⅰ是将
转化为
,反应中
的作用是。写出操作①的名称:。
(2)反应II是铜氨溶液中的
与有机物RH反应,写出该反应的离子方程式:。操作②用到的主要仪器名称为,其目的是(填序号)。
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加
在水中的溶解度
(3)反应Ⅲ是有机溶液中的
与稀硫酸反应生成
和。若操作③使用下图装置,图中存在的错误是。
(4)操作④以石墨作电极电解
溶液。阴极析出铜,阳极产物是。操作⑤由硫酸铜溶液制胆矾的主要步骤是。
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是。循环使用的
在反应Ⅰ中的主要作用是。
是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料]
在260
和400
时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)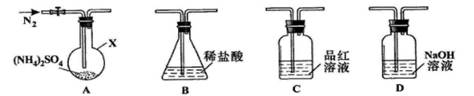
实验1:连接装置
,检查气密性,按图示加入试剂(装置
盛0.5000
盐酸70.00
)。通入
排尽空气后,于260
加热装置
一段时间,停止加热,冷却,停止通入
。品红溶液不褪色,取下装置
,加入指示剂,用0.2000
溶液滴定剩余盐酸,终点时消耗
溶液25.00
。经检验滴定后的溶液中无
。
(1)仪器
的名称是。
(2)滴定前,下列操作的正确顺序是(填字母编号)。
a.盛装0.2000
溶液
b.用0.2000
溶液润洗
c.读数、记录
d.查漏、清洗
e.排尽滴定管尖嘴的气泡并调整液面
(3)装置
内溶液吸收气体的物质的量是
实验2:连接装置
,检查气密性,按图示重新加入试剂。通入
排尽空气后,于400
加热装置
至
完全分解无残留物,停止加热,冷却,停止通入
。观察到装置
、
之间的导气管内有少量白色固体。经检验,该白色固体和装置
内溶液中有
,无
。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置
内溶液中有
,无
的实验操作和现象是.
(5)装置
内溶液吸收的气体是.
(6)
在400
分解的化学方程式是.
过氧化钙(
)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在
溶液中加入
;
②不断搅拌的同时加入30%
,反应生成
沉淀;
③经过陈化、过滤,水洗得到
,再脱水干燥得到
。
完成下列填空
2.第①步反应的化学方程式为。第②步反应的化学方程式为。
3.可循环使用的物质是。
工业上常采用
过量而不是
过量的方式来生产,这是因为。
4.检验
是否洗净的方法是。
5.
加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是、。
6.已知
在350
迅速分解生成
和
。下图是实验室测定产品中
含量的装置(夹持装置省略)。

若所取产品质量是
,测得气体体积为
(已换算成标准状况),则产品中
的质量分数为(用字母表示)。
过氧化钙的含量也可用重量法测定,需要测定的物理量有。
毒重石的主要成分
(含
、
、
等杂质),实验室利用毒重石制备
的流程如下

(1)毒重石用盐酸浸取前需充分研磨,目的是。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
| 开始沉淀时的 | 11.9 |
9.1 |
1.9 |
| 完全沉淀时的 | 13.9 |
11.1 |
3.2 |
加入
调节
=8可除去(填离子符号),滤渣Ⅱ中含(填化学式)。加入
时应避免过量,原因是。
已知:
=1.6×10-7,
=2.3×10-9
(3)利用简洁酸碱滴定法可测定
的含量,实验分两步进行。
已知:
↓
步骤I:移取
一定浓度的
溶液与锥形瓶中,加入酸碱指示剂,用
盐酸标准液滴定至终点,测得滴加盐酸体积为
。
步骤II:移取
溶液于锥形瓶中,加入
与步骤Ⅰ相同浓度的
溶液,待
完全沉淀后,再加入酸碱指示剂,用
盐酸标准液滴定至终点,测得滴加盐酸的体积为
。
滴加盐酸标准液时应用酸式滴定管,"0"刻度位于滴定管的(填"上方"或"下方")。
溶液的浓度为
,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,
浓度测量值将(填"偏大"或"偏小")。